Đề kiểm tra Hóa học kỳ 1 -Lớp 11 - ban cơ bản
Bạn đang xem tài liệu "Đề kiểm tra Hóa học kỳ 1 -Lớp 11 - ban cơ bản", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
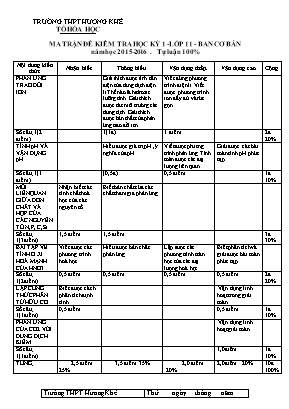
TRƯỜNG THPT HƯƠNG KHÊ TỔ HÓA HỌC MA TRẬN ĐỀ KIÊM TRA HỌC KỲ 1 -LỚP 11 - BAN CƠ BẢN năm học 2015-2016 . Tự luận 100% Nội dung kiến thức Nhận biết Thông hiểu Vận dụng thấp. Vận dụng cao Cộng PHẢN ỨNG TRAO ĐỔI ION Giải thích được tính dẫn điện của dung dịch điện li.Thế nào là hidroxit lưỡng tính .Giải thích được các môi trường các dung dịch. Giải thích được bản chất của phản ứng trao đổi ion. Viết đúng phương trình điện li.Viết được phương trình ion đầy đủ và rút gọn . Số câu; 1(2 điểm) 1(1đ) 1 điểm 2đ 20% TÍNH pH VÀ VẬN DỤNG pH Hiểu được giá trị pH ,ý nghĩa của pH Viết đượcphương trình phản ứng .Tính toán được các đại lượng liên quan . Giải được các bài toán tính pH phức tạp Số câu; 1(1 điểm) (0,5đ) 0,5 điểm 1đ 10% MỐI LIÊNQUAN GIỮA ĐƠN CHẤT VÀ HỢP CỦA CÁC NGUYÊN TỐ N,P, C,Si. Nhận biết các tính chất hoá học của các nguyên tố Biết bản chất cúa các chất tham gia phản ứng . Số câu; 1(3điểm) 1,5 điểm 1,5 điểm 3đ 30% BÀI TẬP VỀ TÍNH O XI HOÁ MẠNH CỦA HNO3 Viết được các phương trình hoá học Hiểu được bản chất phản ứng Lập được các phương trình toán học của các đại lượng hoá học Biết phân tích và giải được bài toán phức tạp Số câu; 1(2điểm) 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 2đ 20% LẬP CÔNG THỨC PHÂN TỬ HỮU CƠ Biết được cách phân tích định tính Vận dụng linh hoạt trong giải toán Số câu; 1(1điểm) 0,5 điểm 0,5 điểm 1đ 10% PHẢN ỨNG CỦA CO2 VỚI DUNG DỊCH KIỀM Vận dụng linh hoạt giải toán Số câu; 1(1điểm) 1,0điểm 1đ 10% TỔNG; 2,5 điểm . 25% 3,5 điểm .35% 2,0 điểm .20% 2,0điểm . 20% 10đ 100% Trường THPT Hương Khê Thứ ......ngày...... tháng..... năm 201... Tổ Hoá học Kiểm tra chất lượng học kỳ 1 năm học 2015-2016 Bộ môn : hoá học -lớp 11 Thời gian làm bài : 45 phút Họ và tên :.......................................... Lớp 11A... Điểm Lời phê của thầy (cô giáo) Đề : Câu 1( 3 điểm) : 1.Viết phương trình phân tử, phương trình ion đầy đủ và phương trình ion rút gọn cho các phản ứng sau xảy ra trong dung dịch (nếu có). a. Na2CO3 + HCl à b. NaOH + Al(OH)3 à c. Na2SO4 + BaCl2 → d. Fe(NO3)3 + KOH → 2.Hòa tan 100ml HCl 1M vào 400ml NaOH 1M thu được dung dịch X.Tính nồng độ mol các ion và pH của dung dịch X. Câu 2 (3 điểm) : Viết các phương trình phản ứng thực hiện dãy biến hoá ( ghi điều kiện phản ứng ) 1. N2àNOàNO2àHNO3 àCO2. 2. COà CO2 → CaCO3 → Ca(HCO3)2 → CaCl2 . 3.HNO3Cu(NO3)2O2P2O5H3PO4 Câu 3( 2điểm): Hoà tan hoàn toàn 13,9 gam hỗn hợp X gồm Al, Fe trong dd HNO3 31,5% loãng (vừa đủ) thấy thoát ra 6,72 lít khí NO (ở đktc) là sản phẩm khử duy nhất . 1.Tính thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp X. 2. Tính khối lượng dung dịch HNO3 cần dùng . Cho: H =1; N =14; O =16; Al =27 ; Fe = 56. Câu 4(2điểm ): 1.. Đốt cháy hoàn toàn 0,92 g HCHC A thu được 1,76 g CO2 và 1,08 g H2O. biết rằng hoá hơi 0,92 g A thu được thể tích đúng bằng thể tích của 0,32g oxi .Lập công thức phân tử của A . Cho: C = 12 . 2..Sục từ từ V lít khí CO2 (đktc) vào 200ml dung dịch Ca(OH)2 1M thu được 15 gam kết tủa. Tìm V . Cho : Ca = 40. ........................HẾT................................. BÀI LÀM ........................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................ Trường THPT Hương Khê Thứ ......ngày...... tháng..... năm 201... Tổ Hoá học Kiểm tra chất lượng học kỳ 1 năm học 2015-2016 Bộ môn : hoá học -lớp 11 Thời gian làm bài : 45 phút Họ và tên :.......................................... Lớp 11A... Điểm Lời phê của thầy (cô giáo) Đề : Câu 1( 3 điểm) : 1.Viết phương trình phân tử, phương trình ion đầy đủ và phương trình ion rút gọn cho các phản ứng sau xảy ra trong dung dịch (nếu có). a. (NH4)2SO4 + BaCl2 " b. NaHCO3 + HCl " c. K2CO3 + Mg(NO3)2 " d. NaOH + Al(OH)3 à 2. Tính thể tích dung dịch Ba(OH)2 0,025M cần cho vào 100ml dung dịch gồm HNO3 và HCl có pH = 1 để pH của hỗn hợp thu được bằng 2. Câu 2 (3 điểm) : Viết các phương trình phản ứng thực hiện dãy biến hoá ( ghi điều kiện phản ứng ) 1.NH4NO3 NaNO3 O2 HNO3 H3PO4 2. HNO3Cu(NO3)2O2P2O5H3PO4 3. NaHCO3 → BaCO3 → Ba(HCO3)2 → Ba(NO3)2 → HNO3 Câu 3( 2điểm): Hòa tan hoàn toàn m(g) kim loại Mg và Cu vào dung dịch HNO3 31,5%. Sau phản ứng thu được dung dịch A và 5,6 (l) khí NO (sản phẩm khử duy nhất). Cô cạn dung dịch A được 65,5 (g) muối khan. a) Tìm m. b) Tính khối lượng dung dịch HNO3 đã dùng vừa đủ. Cho: Mg = 24; Cu = 64 . Câu 4(2điểm ): 1.(1điểm) . Đốt cháy hoàn toàn 9 g hợp chất hữu cơ A thu được 8,96 lít khí CO2; 2,24 lít khí N2 và 12,6 g H2O. Thể tích các khí đo ở đktc. Tìm công thức phân tử A, biết tỉ khối hơi của A đối với He là 11,25. 2.(1điểm) . Cho hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 500 g dung dịch Ca(OH)2 1,48%. Dung dịch sau phản ứng chứa chất tan nào? Bao nhiêu gam? Cho: H = 1; C = 12; O = 16; N =14 ; Ca =40 . ..................................HẾT.................................. BÀI LÀM : ...................................................................................................................................................................................................................................................... .................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. TRƯỜNG THPT HƯƠNG KHÊ ĐÁP ÁN VÀ BIỂU ĐIỂM CHẤM BÀI KIỂM TRA HỌC KỲ 1 –HOÁ 11 .NĂM HỌC 2015-2016 TỔ HOÁ HỌC Câu/điểm Đáp án Điểm thành phần Câu 1/2điể 1. (2đ). Đúng mỗi ý được 0,5 điểm . a. Na2CO3 + 2HCl → 2NaCl + CO2 + H2O . 2Na+ + CO32- + 2H+ + 2Cl- → 2Na+ + 2Cl- + CO2 + H2O . CO32- + 2H+ → CO2 + H2O . b. NaOH + Al(OH)3 → Na AlO2 + 2H2O . Na+ + OH- + Al(OH)3 → Na+ + AlO2- + 2H2O . OH- + Al(OH)3 → AlO2- + 2H2O . c. Na2SO4 + BaCl2 → Ba SO4 ↓ + 2NaCl . 2Na+ + SO42- + Ba2+ + 2Cl- → Ba SO4 ↓ +2Na+ + 2Cl- . SO42- + Ba2+ → Ba SO4 ↓ . d. Fe(NO3)3 + 3KOH → Fe(OH)3↓ + 3 KNO3 . Fe3+ + 3NO3- + 3K+ + 3OH- → Fe(OH)3↓ + 3NO3- + 3K+ . Fe3+ + 3OH- → Fe(OH)3↓ 2.(1đ) . nHCl = 0,1* 1 = 0,1 suy ra nH+ = 0,1; nCl-= 0,1 mol . nNaOH = 0,4* 1 = 0,4 mol suy ra nOH- = 0,4 mol ; nNa+ = 0,4 mol . - Tổng thể tích dung dịch sau khi trộn = 100 + 400 = 500ml = 0,5 lít . H+ + OH- → H2O 0,1 mol 0,1 nOH- = 0,4 – 0,1 = 0,3 mol . Nồng độ OH - = 0,3/0,5 = 0,6 mol/l . Nồng độ H+ = 10-14/ 0,6=1,66.10-14mol/l. Vậy pH = -lg 1,66.10-14 = 13,77. Nồng độ Cl- = 0,1/ 0,5= 0,2 mol/l ; nồng độ Na+ = 0,4/ 0,5 = 0,8mol/l . 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ Câu 2/3đ 1. N2 + O2 30000 2NO (1) 2NO +O2 → 2NO2 (2) 4NO2 + O2 + 2H2O → 4 HNO3. (3) . CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O. (4) 2. 2CO + O2 → 2CO2 (5) . CO2 + Ca(OH)2 → CaCO3 + H2O (6) CaCO3 + CO2 + H2O → Ca(HCO3)2 .(7) Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O (8) 3. 2HNO3 + Cu(OH)2 → Cu(NO3)2 +2H2O (9) 2Cu(NO3)2 → 2CuO + O2 + 4NO2 (10) 5O2 + 4P → 2P2O5 (11) P2O5 + 3H2O → 2H3PO4 (12) 0,25 đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ Câu3/2đ 1. -Gọi số mol các kim loại Al và Fe trong hỗn hợp phản ứng lần lượt x và y mol . Ta có 27x + 56y = 13,9 (a) . -Các phương trình phản ứng là : Al + 4HNO3 → Al(NO3)3 + NO + 2H2O (1) x mol 4x x Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (2) ymol 4y y - Tổng số mol khí NO = 6,72/22,4 = 0,3 mol . x + y =0,3 (b) . Từ (a) và(b) ta có x = 0,1 và y =0,2 Vậy % Al = 0,1* 27 *100% : 13,9 = 19,42% %Fe = 0,2* 56* 100% : 13,9 = 80,58% 2. Khối lượng dung dịch HNO3 đã dùng = 4* 0,3 * 63 *100: 31,5 = 240gam 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ Câu4/2đ 1.(1). nC = nCO2 = 1.76/44 =0,04mol mC = 0,48gam nH = 2nH2O = 2.1,08:18 =0,12 mol ; mH = 0,12gam . mO = mA –( mC + mH) = 0,92 – (0,48 + 0,12) = 0,32gam . nO = 0,32 : 16 =0,02 mol . Đặt công thức phân tử hợp chất A là CxHy Oz . x : y :z = nC : nH : nO = 0,04 : 0,12 : 0,02 = 2:6: 1. Công thức đơn giản nhất Của A là C2H6O Do VA =VO2 nên nA=nO2 = 0,32: 32 =0,01 MA = 0,92/0,01 = 92 Công thức phân tử A có dạng (C2H6O)n 46n = 92 suy ra n = 2 .Vậy công thức phân tử của A là C4H12O2 . 2. (1đ). nCa(OH)2 = 0,2.1 =0,2 mol . nCaCO3 = 15;100 =0,15 mol < 0,2 . Trường hợp 1 : Ca(OH)2 dư . CO2 + Ca(OH)2 → CaCO3 + H2O 0,15 0,15 0,15 VCO2 = 0,15* 22,4 + 3,36 lít . Trường hợp 2 : Ca(OH)2 không dư CO2 + Ca(OH)2 → CaCO3 + H2O 0,15 0,15 0,15 2CO2 + Ca(OH)2 → Ca(HCO3)2. 0,1 0,05 Vậy VCO2 = 0,25 * 22,4 = 5,6 lít.đktc 0,25đ TRƯỜNG THPT HƯƠNG KHÊ ĐÁP ÁN VÀ BIỂU ĐIỂM CHẤM BÀI KIỂM TRA HỌC KỲ 1 –HOÁ 11 .NĂM HỌC 2015-2016 TỔ HOÁ HỌC Câu/ điểm Đáp án Điểm thành phần Câu 1(3đ) 1.(2đ). Đúng mỗi ý được 0,5 điểm a.(NH4)2SO4 + BaCl2 → Ba SO4↓ +2NH4Cl 2NH4+ + SO42- + Ba2+ + 2Cl- Ba2+ SO42- → Ba SO4 . b. NaHCO3 + HCl → NaCl + CO2 + H2O . Na+ + HCO3- + H+ +Cl- → Na+ +Cl- + CO2 + H2O . HCO3- + H+ → CO2 + H2O . c. K2CO3 + Mg(NO3)2 → MgCO3↓ + 2KNO3. 2K+ + CO32- + Mg2+ + 2NO3- → MgCO3↓ +K+ + 2NO3- . CO32- + Mg2+ → MgCO3↓ d. NaOH + Al(OH)3 → Na AlO2 + 2H2O. Na+ +OH- + Al(OH)3 → Na+ + AlO2- + 2H2O. OH- + Al(OH)3 → AlO2- + 2H2O. 2. Gọi thể tích dung dịch Ba(OH)2 là V lít suy ra nOH- = 0,05 V Với pH = 1suy ra nồng độ H+ = 0,1 mol/l ; n H+ = 0,1* 0,1 = 0,01 mol. -Với pH = 2 ,môi trường a xit ,sau phản ứng , OH- hết ,H+ dư . Phản ứng : H+ + OH- → H2O. 0,05V 0,05V nH+ dư = 0,01 – 0,05V . -Nồng độ H+ sau phản ứng = (0,01- 0,05V) : (V + 0,1) = 0,01 .Suy ra V = 0,15 lít = 150ml . 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ Câu 2/3đ 1. NH4NO3 + NaOH → NaNO3 + NH3 + H2O (1) 2 NaNO3 → 2 NaNO2 + O2 (2) O2 +4 NO2 + 2 H2O → 4HNO3. (3) P + 5HNO3 đặc → H3PO4 + 5NO2 + H2O (4) 2. 2HNO3 + CuO → Cu(NO3)2 + H2O (5) 2Cu(NO3)2 → 2CuO +4NO2 + O2 (6) 5O2 + 4P → 2P2O5 (7) P2O5 + 3H2O → H3PO4 (8) 3. NaHCO3 + Ba(OH)2 → BaCO3 + NaOH + H2O (9) BaCO3 + CO2 + H2O → Ba(HCO3)2 (10) Ba(HCO3)2 + 2 HNO3 → Ba(NO3)2 + CO2 + H2O . (11) Ba(NO3)2 + H2SO4 đặc → Ba SO4 ↓ + 2 HNO3 (12) . 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ Câu3/2đ a.- Gọi số mol Mg và Cu tham gia phản ứng là x và y mol .ta có 24x + 64y = m (1) nNO = 5,6/22,4 + 0,25 mol -các phương trình phản ứng : 3Mg + 8HNO3 → 3Mg (NO3)2 + 2NO+H2O x mol 8/3x x 2/3x mol 3Cu + 8HNO3 → 3Cu (NO3)2 + 2NO +4H2O y 8/3y y 2/3ymol -Số mol khí NO = 2/3.x + 2/3 .y = 0,25 mol suy ra 2x + 2y = 0,75 (2) . -Tổng khối lượng muối tạo thành = 148x + 188y= 65,5 gam .(3) . Từ (2) và (3) ta được x = 0,125 và y = 0,25 -Khối lượng hỗn hợp kim loại = 24* 0,125+ 64* 0,25= 19 gam . b. Khối lượng dung dịch HNO3 đã dùng = 8/3. 0,375 .63 : 31,5% = 200gam . 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ Câu4/2đ 1. nC = n CO2 = 8,96/22,4 = 0,4 suy ra mC = 0,4*12= 4,8gam nN =2nN2 = 2* 2,24/22,4 = 0,2 mN = 0,2 .14= 2,8gam nH = 2nH2O = 2.12,6/18 = 1,4 suy ra mH = 1,4gam mO = mA –( mC+mH+mN) = 9,0 – (4,8 + 1,4 + 2,8) = o .vậy Akhoong có o xi . -Công thức phân tử A có dạng CxHy Nz . x : y :z = nC : nH : nN = 0,4: 1,4: 0,2 = 2:7:1 .Do đó CTĐGN của A là C2H7N Công thức chung có dạng (C2H7N)n MA = 11,25*4 =45. 45n = 45 n =1 Vậy công thức phân tử của A là C2H7N . 2. nCO2 = 3,36/22,4 = 0,15 mol nCa(OH)2 = 500* 1,48% : 74 = 0,1 mol suy ra nOH- = 0,2 mol . Tỉ lệ : nOH-/nCO2 = 0,2/0,15 = 1,33 ; 1< 1,33< 2 . Sau phản ứng tạo hai muối : CO2 + Ca(OH)2 → CaCO3 ↓ + H2O x mol x x 2 CO2 + Ca(OH)2 → Ca(HCO3)2 . 2y y y mol Ta có : x + 2y = 0,15 và x +y = 0,1 ; x = 0,05 và y =0,05 . Dung dịch sau phản ứng chứa chất tan Ca (HCO3)2 ; m Ca (HCO3)2 = 0,05* 164 = 8,20gam .
Tài liệu đính kèm:
 MA_TRAN_DE_DAP_AN_KIEM_TRA_HOC_KY_1_HOA_11.doc
MA_TRAN_DE_DAP_AN_KIEM_TRA_HOC_KY_1_HOA_11.doc





