Đề kiểm tra giữa học kỳ I môn Hóa Khối 10 - Năm học 2021-2022
Bạn đang xem tài liệu "Đề kiểm tra giữa học kỳ I môn Hóa Khối 10 - Năm học 2021-2022", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
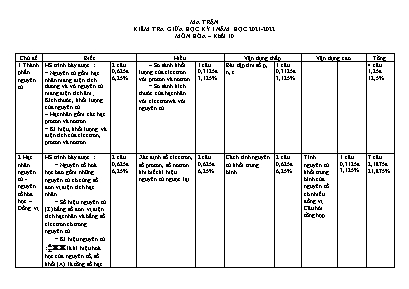
MA TRẬN KIỂM TRA GIỮA HỌC KỲ I NĂM HỌC 2021-2022 MÔN HÓA – Khối 10 Chủ đề Biết Hiểu Vận dụng thấp Vận dụng cao Tổng 1.Thành phần nguyên tử HS trình bày được : - Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm ; Kích thước, khối lượng của nguyên tử. - Hạt nhân gồm các hạt proton và nơtron. - Kí hiệu, khối lượng và điện tích của electron, proton và nơtron. 2 câu 0,625đ 6,25% - So sánh khối lượng của electron với proton và nơtron. - So sánh kích thước của hạt nhân với electron và với nguyên tử. 1 câu 0,3125đ 3,125% Bài tập tìm số p, n, e 1 câu 0,3125đ 3,125% 4 câu 1,25đ 12,5% 2.Hạt nhân nguyên tử - nguyên tố hóa học – Đồng vị HS trình bày được : - Nguyên tố hoá học bao gồm những nguyên tử có cùng số đơn vị điện tích hạt nhân. - Số hiệu nguyên tử (Z) bằng số đơn vị điện tích hạt nhân và bằng số electron có trong nguyên tử. - Kí hiệu nguyên tử : là kí hiệu hoá học của nguyên tố, số khối (A) là tổng số hạt proton và số hạt nơtron. - Khái niệm đồng vị, nguyên tử khối và nguyên tử khối trung bình của một nguyên tố. 2 câu 0,625đ 6,25% Xác định số electron, số proton, số nơtron khi biết kí hiệu nguyên tử ngược lại. 2 câu 0,625đ 6,25% Cách tính nguyên tử khối trung bình 2 câu 0,625đ 6,25% Tính nguyên tử khối trung bình của nguyên tố có nhiều đồng vị. Câu hỏi tổng hợp. 1 câu 0,3125đ 3,125% 7 câu 2,1875đ 21,875% 3.Cấu tạo vỏ nguyên tử - Các electron chuyển động rất nhanh xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định, tạo nên vỏ nguyên tử. - Trong nguyên tử, các electron có mức năng lượng gần bằng nhau được xếp vào một lớp (K, L, M, N, O, P, Q). - Một lớp electron bao gồm một hay nhiều phân lớp. Các electron trong mỗi phân lớp có mức năng lượng bằng nhau. 2 câu 0,625đ 6,25% Xác định được thứ tự các lớp electron trong nguyên tử, số phân lớp (s, p, d) trong một lớp. 1 câu 0,3125đ 3,125% 3 câu 0,9375đ 9,375% 4.Cấu hình electron nguyên tử - Thứ tự các mức - Viết được cấu hình electron nguyên tử của một số nguyên tố hoá học. - Dựa vào cấu hình electron lớp ngoài cùng của nguyên tử suy ra tính chất hoá học cơ bản (là kim loại, phi kim hay khí hiếm) của nguyên tố tương ứng. năng lượng của các electron trong nguyên tử. - Sự phân bố electron trên các phân lớp, lớp và cấu hình electron nguyên tử. - Đặc điểm cấu hình của lớp electron ngoài cùng. 2 câu 0,625đ 6,25% - Viết được cấu hình electron nguyên tử của một số nguyên tố hoá học. - Dựa vào cấu hình electron lớp ngoài cùng của nguyên tử suy ra tính chất hoá học cơ bản (là kim loại, phi kim hay khí hiếm) của nguyên tố tương ứng. 2 câu 0,625đ 6,25% Câu hỏi tổng hợp. 1 câu 0,3125đ 3,125% 5 câu 1,5625đ 15,625% 5.Bảng tuần hoàn HS trình bày được: - Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. - Cấu tạo của bảng tuần hoàn: ô, chu kì, nhóm nguyên tố (nhóm A, nhóm B). 3 câu 0,9375đ 9,375% Mối liên hệ giữa cấu hình và vị trí nguyên tố 2 câu 0,625đ 6,25% Từ vị trí trong bảng tuần hoàn của nguyên tố (ô, chu kì) suy ra cấu hình electron và ngược lại. 1 câu 0,3125đ 3,125% Câu hỏi tổng hợp. 1 câu 0,3125đ 3,125% 7 câu 2,1875đ 21,875% 6.Sự biến đổi tuần hoàn - Đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A; - Sự tương tự nhau về cấu hình electron lớp ngoài cùng của nguyên tử (nguyên tố s, p) là nguyên nhân của sự tương tự nhau về tính chất hoá học các nguyên tố trong cùng một nhóm A; - Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi số điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố. - Trình bày và giải thích được sự biến đổi độ âm điện của một số nguyên tố trong một chu kì, trong nhóm A. - Trình bày được sự biến đổi hoá trị cao nhất với oxi và hoá trị với hiđro của các nguyên tố trong một chu kì. - Nêu được sự biến đổi tính axit, bazơ của các oxit và hiđroxit trong một chu kì, trong một nhóm A. 1 câu 0,3125đ 3,125% - Dựa vào cấu hình electron, xác định nguyên tố s, p. Giải thích được quy luật biến đổi tính kim loại, tính phi kim của các nguyên tố trong một chu kì, trong nhóm A (dựa vào bán kính nguyên tử). - Giải thích được nội dung định luật tuần hoàn. 1 câu 0,3125đ 3,125% Tìm tên nguyên tố theo Quy luật biến đổi hoá trị cao nhất với oxi và hoá trị với hiđro của một số nguyên tố trong một chu kì, trong nhóm A . Tìn tên nguyên tố theo phưng trình hóa học. 2 câu 0,625đ 6,25% 4 câu 1,25đ 12,5% 7.Ý nghĩa Bảng tuần hoàn HS trình bày được: Mối quan hệ giữa vị trí các nguyên tố trong bảng tuần hoàn với cấu tạo nguyên tử và tính chất cơ bản của nguyên tố và ngược lại. 1 câu 0,3125đ 3,125% HS trình bày được: Mối quan hệ giữa vị trí các nguyên tố trong bảng tuần hoàn với cấu tạo nguyên tử và tính chất cơ bản của nguyên tố và ngược lại. 1 câu 0,3125đ 3,125% 2 câu 0,625đ 6,25% Tổng 13 câu 4,0625đ 40,625% 10 câu 3,125đ 31,25% 6 câu 1,875đ 18,75% 3 câu 0,9375đ 9,375% 32 câu 10đ 100%
Tài liệu đính kèm:
 de_kiem_tra_giua_hoc_ky_i_mon_hoa_khoi_10_nam_hoc_2021_2022.docx
de_kiem_tra_giua_hoc_ky_i_mon_hoa_khoi_10_nam_hoc_2021_2022.docx





