Đề kiểm tra Chương V Hoá 8
Bạn đang xem tài liệu "Đề kiểm tra Chương V Hoá 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
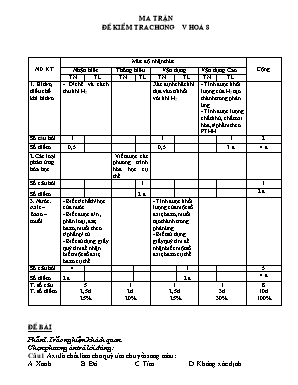
Ma trËn ®Ò kiÓm tra ch¬ng v ho¸ 8 ND KT Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng Cao TN TL TN TL TN TL TN TL 1. Hiđro, điều chế khí hiđro - Đ/chế và cách thu khí H2. Xác định chất khí dựa vào tỉ khối với khí H2 - Tính được khối lượng của H2 tạo thành trong phản ứng. - Tính được lượng chất khử, chất oxi hóa, s/phẩm theo PTHH Số c©u hỏi 1 1 1 2 Số điểm 0,5 0,5 3 đ 4 đ 2.Các loại phản ứng hóa học Viết được các phương trình hóa học cụ thể. Số câu hỏi 1 1 Số điểm 2 đ 2 đ 3. Nước. Axit – Bazơ – muối - Biết t/chất h/học của nước. - Biết được đ/n , phân loại,axit, bazơ, muối theo t/phần p/ tử. - Biết sử dụng giấy quỳ tím để nhận biết một số axit, bazơ cụ thể. - Tính được khối lượng của một số axit, bazơ, muối tạo thành trong phản ứng . - Biết sử dụng giấy quỳ tím để nhận biết một số axit, bazơ cụ thể. Số câu hỏi 4 1 5 Số điểm 2 đ 2 đ 4 đ T. số câu T. số điểm 5 2,5đ 25% 1 2đ 20% 1 2,5đ 25% 1 3đ 30% 8 10đ 100% §Ò bµi Phần I.Trắc nghiệm khách quan Chọn phương án trả lời đúng: Câu 1.Axit là chất làm cho quỳ tím chuyển sang màu: A. Xanh B. Đỏ C. Tím D. Không xác định Câu 2.Chất nào dưới đây có thể dùng để điều chế được hiđrô khi cho tác dụng với dung dịch HCl A.Cu B.Ag C.H2O D.Zn Câu 3.Dãy chất nào dưới đây gồm các axit có oxi: A.HCl,H2S,HNO3 C.HCl,H2SO4,HNO3 B.H2SO4,HNO3,H3PO4 D.H2S,HNO3,H2SO4 Câu 4.Dãy chất nào sau đây gồm các bazo tan trong nước: A.Cu(OH)2,NaOH,FeCl3 C.KOH,NaOH,Ba(OH)2 B.NaOH,HCl,K2O D.KCl,Fe(OH)3,Ba(OH)2 Câu 5.Dãy chất nào tác dụng với nước: A.SO3,CaO,P2O5 C.Al2O3,SO3,CaO B.Na2O,CuO,P2O5 D.CuO,Al2O3,Na2O Câu 6.Khí X có tỷ khối với H2 là 8,5g.X là khí nào cho dưới đây: A.SO2 B.NH3 C.O2 D.Cl2 Phần II.Tự luận Câu 1. ( 2đ) Hoàn thành các phương trình phản ứng sau: a. P + .----> P2O5 b. Al + HCl à c. .. + à MgO d. Na + H2O à +. Câu 2. (2đ) Hãy nhận biết từng chất trong nhóm chất sau bằng phương pháp hóa học: H2O,dung dịch HCl,dung dịnh NaOH. Câu 3. (3đ) Cho 13 gam Zn phản ứng hoàn toàn với dung dịnh HCl dư. a.Viết phương trình hóa học xảy ra. b.Tính thể tích H2 ở điều kiện tiêu chuẩn. c.Nếu dùng toàn bộ lượng H2 bay ra ở trên đem khử 12g bột CuO ở nhiệt độ cao thì chất nào còn dư?dư bao nhiêu gam. (Biết S=32; O=16; N=14; H=1; Cl=35,5; Zn=65) ®¸p ¸n – BIỂU ®iÓm PhÇn I. Tr¾c nghiÖm kh¸c quan (3 ®iÓm) Mçi ph¬ng ¸n chän ®óng ®îc 0,5 ®iÓm C©u 1 2 3 4 5 6 §¸p ¸n B D B C A B PhÇn II. Tù luËn (7 ®iÓm) Lêi gi¶i §iÓm C©u 1 (2 ®iÓm). Ph¬ng tr×nh ph¶n øng 0,5 ®iÓm to a. 4P + 5O2 à 2P2O5 0,5 ®iÓm b. 2Al + 6HCl à 2AlCl3 + 3H2 0,5 ®iÓm to c. 2Mg + O2 à 2MgO d. 2Na + 2H2O à 2NaOH + H2 0,5 ®iÓm C©u 2 (1,5 ®iÓm) - Dïng quú tÝm ®Ó nhËn ra 3 chÊt ®· cho 0,5 ®iÓm - NÕu quú tÝm à §á à dung dÞch HCl 0,5 ®iÓm - NÕu quú tÝm à Xanh à dung dÞch NaOH 0,5 ®iÓm - Quú tÝm kh«ng ®æi mµu lµ H2O C©u 3 (3,5). a. Ph¬ng tr×nh ho¸ häc Zn + 2HCl à ZnCl2 + H2 0,25 ®iÓm 13 b. nZn = = 0,2 mol 65 0,25 ®iÓm Theo ph¬ng tr×nh: nH2 = nZn = 0,2 mol 0,5 ®iÓm => VH2 ë ®ktc lµ: 0,2 . 22,4 = 4,48 lÝt 0,5 ®iÓm to c. H2 + CuO à Cu + H2O 1 mol 1 mol 0,2 mol 0,15 mol 0,5 ®iÓm 0,2 0,15 Ta cã: > à H2 d 1 1 0,5 ®iÓm nH2 d = 0,2 - 0,15 = 0,05 mol 0,5 ®iÓm mH2 d = 0,05 . 2 = 0,1 gam 0,5 ®iÓm
Tài liệu đính kèm:
 kiem_tra_hoa_8_tiet_59.doc
kiem_tra_hoa_8_tiet_59.doc





