Đề cương Hóa học lớp 8 học kì 2
Bạn đang xem tài liệu "Đề cương Hóa học lớp 8 học kì 2", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
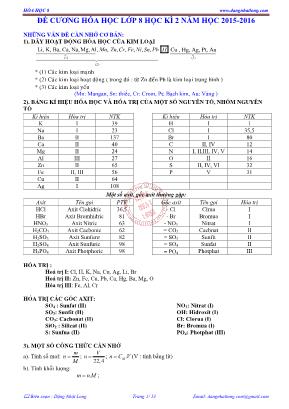
HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 1/ 13 Email: [email protected] ĐỀ CƢƠNG HĨA HỌC LỚP 8 HỌC KÌ 2 NĂM HỌC 2015-2016 NHỮNG VẤN ĐỀ CẦN NHỚ CƠ BẢN: 1). DÃY HOẠT ĐỘNG HĨA HỌC CỦA KIM LOẠI (1) (2) Li, K, Ba, Ca, Na,Mg,Al, , , , , , ,Mn Zn Cr Fe Ni Sn Pb H (3) Cu , Hg, Ag, Pt, Au * (1) Các kim loại mạnh * (2) Các kim loại hoạt động ( trong đó : từ Zn đến Pb là kim loại trung bình ) * (3) Các kim loại yếu (Mn: Mangan, Sn: thiếc, Cr: Crom, Pt: Bạch kim, Au: Vàng ) 2). BẢNG KÍ HIỆU HĨA HỌC VÀ HĨA TRỊ CỦA MỘT SỐ NGUYÊN TỐ, NHĨM NGUYÊN TỐ Kí hiệu Hĩa trị NTK Kí hiệu Hĩa trị NTK K I 39 H I 1 Na I 23 Cl I 35,5 Ba II 137 Br I 80 Ca II 40 C II, IV 12 Mg II 24 N I, II,III, IV, V 14 Al III 27 O II 16 Zn II 65 S II, IV, VI 32 Fe II, III 56 P V 31 Cu II 64 Ag I 108 Một số axit, gốc axit thường gặp: Axit Tên gọi PTK Gốc axit Tên gọi Hĩa trị HCl Axit Clohiđric 36,5 - Cl Clrua I HBr Axit Bromhiđric 81 - Br Bromua I HNO3 Axit Nitric 63 - NO3 Nitrat I H2CO3 Axit Cacbonic 62 = CO3 Cacbnat II H2SO3 Axit Sunfurơ 82 = SO3 Sunfit II H2SO4 Axit Sunfuric 98 = SO4 Sunfat II H3PO4 Axit Photphoric 98 PO4 Photphat III HĨA TRỊ : Hố trị I: Cl, H, K, Na, Cu, Ag, Li, Br Hố trị II: Zn, Fe, Cu, Pb, Ca, Hg, Ba, Mg, O Hĩa trị III: Fe, Al, Cr HĨA TRỊ CÁC GỐC AXIT: SO4 : Sunfat (II) SO3: Sunfit (II) CO3: Cacbonat (II) SiO2 : Silicat (II) S: Sunfua (II) NO3: Nitrat (I) OH: Hidroxít (I) Cl: Clorua (I) Br: Bromua (I) PO4: Photphat (III) 3). MỘT SỐ CƠNG THỨC CẦN NHỚ a). Tính số mol: M m n ; 22,4 V n ; .Mn C V (V : tính bằng lít) b). Tính khối lượng: .m n M ; HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 2/ 13 Email: [email protected] * % 100 dd ct m C m ; c). Tính thể tích: .22,4V n ; M n V C ; ddmV D ; d). Tính khối lượng dung dịch: .100 % ct dd m m C ; . ( : )ddm DV V ml ; 2dd ct H O m m m ; e). Tỉ khối hơi của chất A so với chất B: B A BA M M d / ; 29 / A kkA M d ; f). Nồng độ dung dịch: M n C V (V: tính bằng lít) g). Nồng độ phần trăm: dd ct m m C 100* % ; h). Độ tan : dd ct m m C 100* % I. TÍNH CHẤT CỦA OXI: 1) Tính chất vật lí: Oxi là chất khí khơng màu, khơng mùi, ít tan trong nước, nặng hơn khơng khí. Oxi hĩa lỏng ở - 1830C. Oxi lỏng cĩ màu xanh nhạt. 2) Tính chất hĩa học: Oxi là một phi kim khá hoạt động, tác dụng với kim loại, phi kim và nhiều hợp chất. Trong hợp chất oxi cĩ hĩa trị II. a) Oxi tác dụng với phi kim: C + O2 otCO2. S + O2 ot SO2. 4P + 5O2 ot 2P2O5. b) Oxi tác dụng với kim loại: 3Fe + 2O2 ot Fe3O4. 4Na + O2 ot 2Na2O 2Mg + O2 ot 2MgO c) Oxi tác dụng với hợp chất: C2H5OH + 3O2 ot 2CO2 + 3H2O 2CO + O2 ot 2CO2. CH4 + 2O2 otCO2 + 2H2O II. ĐIỀU CHẾ KHÍ OXI: 1). Điều chế khí oxi trong phịng thí nghiệm: Đung nĩng KMnO4, KClO3. 2KMnO4 ot K2MnO4 + MnO2 + O2. 2KClO3 ot 2KCl + 3O2. 2) Sản xuất oxi trong cơng nghiệp: + Chưng cất phân đoạn khơng khí lỏng: Hố lỏng khơng khí ở nhiệt độ thấp và áp suất cao, sau đĩ cho khơng khí lỏng bay hơi sẽ thu được khí nitơ ở -1960C sau đĩ là khí oxi ở -1830C + Điện phân nước 2H2O dp 2H2 + O2. HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 3/ 13 Email: [email protected] III. KHƠNG KHÍ – SỰ OXI HĨA - SỰ CHÁY: 1). Thành phần của khơng khí: - Khơng khí là hỗn hợp nhiều chất khí. - Thành phần theo thể tích của khơng khí là: + 21% khí O2 . + 78% khí N2 . + 1% các khí khác ( khí cacbonic, hơi nước, khí hiếm) 2). Sự oxi hĩa: Sự tác dụng của oxi với 1 chất là sự oxi hĩa 3). Sự cháy: là sự oxi hĩa cĩ toả nhiệt và phát sáng. Ví dụ: Đốt than 4). Sự oxi hĩa chậm: là sự oxi hĩa cĩ toả nhiệt nhưng khơng phát sáng. Ví dụ: Thanh sắt để ngồi nắng. 5) Điều kiện phát sinh và các biện pháp dập tắt sự cháy a). Các điều kiện phát sinh sự cháy: - Chất phải nĩng đến nhiệt độ cháy. - Phải cĩ đủ oxi cho sự cháy. b). Các biện pháp để dập tắt sự cháy: - Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy. - Cách li chất cháy với oxi. IV. OXIT: 1. Định nghĩa: Oxit là hợp chất hai nguyên tố trong đĩ cĩ một nguyên tố oxi. 2. Phân loại: a) Oxit axit: Thường là oxit của phi kim và tương ứng với một axit. Ví dụ: CO2 tương ứng với axit H2CO3. SO3 tương ứng với axit H2SO4. P2O5 tương ứng với axit H3PO4. b) Oxit bazơ: Là oxit của kim loại và tương ứng với một bazơ. Ví dụ: Na2O tương ứng với bazơ NaOH CuO tương ứng với bazơ Cu(OH)2. Fe2O3 tương ứng với bazơ Fe(OH)3. 3) Cách gọi tên: Tên oxit = tên nguyên tố + oxit. + Kim loại cĩ nhiều hĩa trị Tên gọi = tên kim loại (hĩa trị) + oxit Ví dụ: Na2O: Natri oxit Fe2O3: Sắt (III) oxit K2O: kali oxit CuO: đồng (II) oxit + Nếu phi kim cĩ nhiều hĩa trị Tên gọi = Tiền tố chỉ số nguyên tử phi kim +Tên phi kim + tố chỉ số nguyên tử oxi + oxit Tiền tố chỉ số nguyên tử như sau: mono: một; đi: hai; tri: ba; tetra: bốn, penta: năm; Ví dụ: N2O5: đinitơ pentaoxit SiO2: silic đioxit SO2: lưu huỳnh đioxit P2O5: điphotpho pentaoxit V: HIDRO: 1. Tính chất vật lí: + Hidro là chất khí khơng màu, khơng mùi, khơng vị. + Nhẹ nhất trong các khí ( 29 2 2 KK Hd ), tan rất ít trong nước. 2. Tính chất hĩa học: a) Tác dụng với oxi: - Khí H2 cháy trong khơng khí với ngọn lửa nhỏ. - Khí H2 cháy mãnh liệt trong oxi với ngọn lửa xanh mờ. Kết luận: H2 tác dụng với oxi sinh ra H2O, phản ứng gây nổ 2H2 + O2 0t 2H2O HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 4/ 13 Email: [email protected] Tỉ lệ: 2H V : 2O V = 2:1 + Khi đốt cháy hỗn hợp H2 và O2 theo tỉ lệ 2:1 sẽ gây nổ mạnh nhất. b) Tác dụng với đồng oxit: H2 + CuO 0t Cu + H2O (màu đen) (màu đỏ) Nhận xét: Khí H2 đã chiếm nguyên tố O2 trong hợp chất CuO. Khí H2 cĩ tính khử. Kết luận: Ở nhiệt độ thích hợp, H2 khơng những kết hợp được với đơn chất O2 mà cịn cĩ thể kết hợp với nguyên tố oxi trong 1 số oxit kim loại. Các phản ứng này đều toả nhiều nhiệt. Ví dụ: H2 + PbO 0t Pb + H2O Fe2O3 + 3H2 2Fe + 3H2O 3. Ứng dụng của Hidro: - Bơm kinh khí cầu - Sản xuất nhiên liệu. - Hàn cắt kim loại, khử oxi của một số oxit kim loại. - Sản xuất amoniac, axit, phân đạm.... 4. Điều chế hidro. a). Trong phịng thí nghiệm: - Khí H2 được điều chế bằng cách: cho axit (HCl, H2SO4(l)) tác dụng với kim loại (Zn, Al, Fe, ) - Phương trình hĩa học: Zn + 2HClZnCl2 + H2 - Nhận biết khí H2 bằng que đĩm đang cháy. - Thu khí H2 bằng cách: + Đẩy nước. + Đẩy khơng khí. b). Trong cơng nghiệp: Điện phân nước 2H2O dp 2H2 + O2. VI. NƢỚC: 1. Thành phần hĩa học của nƣớc: - Sự phân hủy nước: 2H2O dp 2H2 + O2. - Sự hĩa hợp nước: 2H2 + O2 0t 2H2O Kết luận: - Nước là hợp chất tạo bởi 2 nguyên tố: H & O. - Tỉ lệ hố hợp giữa H & O: + Về thể tích: 2 2 H O V V = 1 2 + Về khối lượng: 2 2 H O m m = 8 1 - CTHH của nước: H2O. 2. Tính chất vật lí: Nước là chất lỏng, khơng màu, khơng mùi và khơng vị, sơi ở 1000C, khối lượng riêng 1 g/ml. Hồ tan nhiều chất: rắn, lỏng, khí 3. Tính chất hĩa học: a) Tác dụng với kim loại: 2Na + 2H2O 2NaOH + H2 Bazơ Nước cĩ thể tác dụng với một số kim loại mạnh khác như K, Ca, Ba... b) Tác dụng với một số oxit bazơ. CaO + H2O Ca(OH)2. (bazơ) Nước cũng hĩa hợp Na2O, K2O, BaO... tạo NaOH, KOH Dung dịch bazơ làm đổi màu quì tím thành xanh. HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 5/ 13 Email: [email protected] c) Tác dụng với một số oxit axit. P2O5 + 3H2O 2H3PO4 (axit). Nước cũng hĩa hợp nhiều oxit khác như SO2, SO3, N2O5... tạo axit tương ứng. Dung dịch axit làm đổi màu quì tím thành đỏ. VII. AXIT: 1- Khái niệm: Phân tử axít gồm một hay nhiều nguyên tử hiđrơ liên kết với gốc axít, các nguyên tử hiđrơ này cĩ thể thay thế bằng các nguyên tử kim loại. Ví dụ: HCl, H2SO4, HNO3, H3PO4 2. Cơng thức của axít. HnA - n: là chỉ số của nguyên tử H - A: là gốc axít (-Cl, = SO3, = SO4, = S, - NO3, PO4) 3. Phân loại axít. -Axit khơng cĩ oxi: HCl, H2S. -Axit cĩ oxi: HNO3, H2SO4, H3PO4 4. Gọi tên của axít. a. Axít cĩ oxi: Tên axit = axit + PK + ic Ví du: HNO3 axit nitric ; H2SO4 axit sunfuric H3PO4 axit photphoric H2CO3 axit cacbonic. b. Axít khơng cĩ oxi: Tên axit = axit + PK + hiđic Ví dụ: H2S axit sunfuhidric. HCl axitclohiđríc HBr axit bromhiđic. c. Axít cĩ ít oxi: Tên axit = axit + PK + ơ Ví dụ: H2SO3 axit sunfurơ VIII. BAZƠ: 1. Định nghĩa: Bazơ là một phân tử gồm một nguyên tố kim loại liên kết một hay nhiều nhĩm hiđroxit (OH ). Ví dụ: NaOH, Ca(OH)2; Mg(OH)2; Fe(OH)3, 2. Cơng thức bazơ: M(OH)n - M: là nguyên tố kim loại - n:là chỉ số của nhĩm (OH ) 3. Phân loại bazơ -Bazơ tan ( kiềm), tan được trong nước Ví dụ: NaOH; Ca(OH)2, KOH, Ba(OH)2... -Bazơ khơng tan, khơng tan được trong nước. Ví dụ: Fe(OH)3; Cu(OH)2, Mg(OH)2, .. 4. Cách đọc tên bazơ Tên bazơ = Tên kim loại (nếu kim loại cĩ nhiều hố trị gọi tên kèm theo tên hố trị) + hiđroxit. Ví dụ: Ca(OH)2 Canxi hidroxit Fe(OH)2 sắt (II) hidroxit; Fe(OH)3 sắt (III) hidroxit IX. MUỐI: 1. Khái niệm: Phân tử muối gồm cĩ một hay nhiều nguyên tử kim loại liên kết một hay nhiều gốc axít. Ví dụ: NaCl, K2CO3, NaH2PO4, BaCO3, Na2SO4, Na2HPO4, K2SO4, Fe(NO3)3 2. Cơng thức hố học của muối: MxAy. Trong đĩ: - M: là nguyên tố kim loại. - x: là chỉ số của M. - A: Là gốc axít - y: Là chỉ số của gốc axít. 3.Cách đọc tên muối: Tên muối = tên kim loại ( kèm hố trị kim loại cĩ nhiều hố trị) + tên gốc axít. 4. Phân loại muối: HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 6/ 13 Email: [email protected] a. Muối trung hồ: Là muối mà trong gốc axít khơng cĩ nguyên tử “ H” cĩ thể thay thế bằng nguyên kim loại. VD: ZnSO4; Cu(NO3)2 b. Muối axít: Là muối mà trong đĩ gốc axít cịn nguyên tử “H” chưa được thay thế bằng nguyên tử kim loại. VD: NaHCO3; Ca(HCO3)2 X. CÁC PHƢƠNG TRÌNH PHẢN ỨNG: 1. Kim loại 2O Oxit Bazơ Ví dụ: 2Cu + O2 2CuO 2Mg + O2 2MgO 4Fe + 3O2 0t 2Fe2O3 4AI + 3O2 0t 2Al2O3 2. Phi kim 2O Oxit Axit Ví dụ: C + O2 CO2 N2 + 2O2 2NO2 3. Oxit Axit 2H O Axit Ví dụ: P2O5 + 3H2O 2H3PO4 SO2 + H2O H2SO3 4. Oxit Bazơ 2H O Bazơ (Chỉ cĩ Kim loại tan trong nước) (Một số oxit bazơ tác dụng với nước tao thành dd bazơ (Kiềm) Ví dụ: CaO + H2O Ca(OH)2 Na2O + H2O 2NaOH K2O + H2O 2KOH 5. Axit Bazơ Muối 2H O Ví dụ: Ca(OH)2 + HCl CaCl2 + H2O Mg(OH)2 + H2SO4 MgSO4 + 2H2O 6. Kim loại Axit Muối 2H (Kim loại đứng trước H2 trong dãy hoạt động kim loại) Ví dụ: 6HCl lỗng + 2Al 2AlCl3 + 3H2 H2SO4 lỗng + Fe 2FeSO4 + H2 7. Kim loại + 2H O Bazơ 2H (Chỉ cĩ kim loại tan trong nước như : Li, Na, K, Ca, Ba ) (Một số oxit bazơ tác dụng với nước tao thành dd bazơ (Kiềm) Ví dụ: Ca + 2H2O ot Ca(OH)2 + H2 2Na + 2H2O 2NaOH + H2 2K + 2H2O 2KOH + H2 8. Axit + Oxit bazơ Muối + H2O Ví dụ: Na2O + 2HCl 2NaCl + H2O MgO + H2SO4 MgSO4 + H2O 9. Oxit Axit + dd Bazơ Muối + H2O Ví dụ: SO3 + 2NaOH Na2SO4 + H2O 10. Oxit bazơ + Oxit axit Muối HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 7/ 13 Email: [email protected] Ví dụ: Na2O + CO2 Na2CO3 CaO + SO2 CaSO3 CO2 + CaO CaCO3 SO3 + K2O K2SO3 XI. CÁC LOẠI PHẢN ỨNG: 1. Phản ứng hĩa hợp: là phản ứng hĩa học trong đĩ chỉ cĩ một chất mới được tạo thành từ hai hay nhiều chất ban đầu. Ví dụ: 3Fe + 2O2 0t Fe3O4. 4Na + O2 0t 2Na2O 2CO + O2 0t 2CO2. 2. Phản ứng phân hủy: là phản ứng hĩa học trong đĩ một chất sinh ra hai hay nhiều chất mới Ví dụ: 2 H2O dp 2H2+ O2. 2KMnO4 0t K2MnO4 + MnO2 + O2. 2KClO3 0t2KCl + 3O2. 0t 3 2 3 22Fe(OH) Fe O +3H O 0t 3 2 3 22Al(OH) Al O +3H O 3. Phản ứng thế: là phản ứng hĩa học giữa đơn chất và hợp chất, trong đĩ nguyên tử của đơn chất thay thế nguyên tử của 1 nguyên tố trong hợp chất. Ví dụ: Zn + 2HCl ZnCl2 + H2 2Al + 3H2SO4 Al2(SO4)3 + 3H2 (đ.chất) (h.chất) (h.chất) (đ.chất) 4. Phản ứng oxi hố- khử: là phản ứng hố học trong đĩ xảy ra đồng thời sự oxi hố và sự khử. Ví dụ: CuO + H2 0t Cu + H2O BÀI TẬP: DẠNG 1: TÍNH THÀNH PHẦN % THEO KHỐI LƢỢNG CỦA CÁC NGUYÊN TỐ TRONG HỢP CHẤT AXBY. %100. . %100.%,%100. . %100.% yxyxyxyx BA B BA B BA A BA A M yM M m B M xM M m A - Trong đĩ: BA,%% là phần trăm theo khối lượng của các nguyên tố A, B trong AxBy. mA, mB là khối lượng của nguyên tố A, B trong AxBy. yxBABA MMM ,, là nguyên tử khối và phân tử khối của A, B, AxBy. Câu 1: Tính thành phần phần trăm theo khối lượng của các nguyên tố trong các hợp chất sau: a. NaCl b. FeCl2 c. CuSO4 d. K2CO3 Câu 2: Cho các oxit sắt sau: FeO, Fe2O3, Fe3O4. Hãy so sánh hàm lượng sắt cĩ trong các oxit trên ? Câu 3: Co các chất: CuO, CuS, CuCO3, CuSO4, CuCl2. Hãy so sánh hàm lượng đồng cĩ trong các hợp chất trên ? DẠNG 2: LẬP CƠNG THỨC HĨA HỌC CỦA HỢP CHẤT KHI BIẾT THÀNH PHẦN PHẦN TRĂM (%) VỀ KHỐI LƢỢNG CÁC NGUYÊN TỐ. 1. Bài tập tổng quát: Cho một hợp chất gồm 2 nguyên tố A và B cĩ tỉ lệ % về khối lượng các nguyên tố trong hợp chất là %A và %B. Tìm cơng thức của hợp chất ? 2. Phương pháp giải: Gọi cơng thức hĩa học của hợp chất hai nguyên tố cĩ dạng AxBy (3 nguyên tố cĩ dạng AxByCz). - Từ cơng thức ở phần (II ở trên) ta cĩ: %100. .% %100. . % %100. .% %100. . % B BA BA B A BA BA A M BM y M yM B M AM x M xM A yx yx yx yx → Cơng thức của hợp chất. HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 8/ 13 Email: [email protected] Hoặc BA M B M A yx % : % : (Tỉ lệ số nguyên tối giản) → Cơng thức đơn giản của hợp chất 3. Bài tập vận dụng: Câu 1: Xác định các cơng thức hĩa học của các oxit sau: a. Biết phân tử khối của oxit là 80 và thành phần %S = 40%. b. Biết thành phần %Fe = 70% và phân tử khối của oxit là 160. Câu 2: Xác định cơng thức phân tử của các hợp chất sau: a. Hợp chất B cĩ thành phần phần trăm của các nguyên tố là 39,32%Na, 25,54%C, 28,07% O và khối lượng mol của hợp chất là 142. b. Hợp chất A cĩ khối lượng mol là 152 và phần trăm theo khối lượng của các nguyên tố là 36,84%Fe, 21,05%S, 42,11%O. DẠNG 3: LẬP CƠNG THỨC HĨA HỌC DỰA VÀO TỈ LỆ KHỐI LƢỢNG CỦA CÁC NGUYÊN TỐ. 1. Bài tập tổng quát: Cho một hợp chất gồm 2 nguyên tố A và B cĩ tỉ lệ về khối lượng là a : b hay b a m m B A . Tìm cơng thức của hợp chất ? 2. Phương pháp giải: Gọi cơng thức hĩa học của hợp chất hai nguyên tố cĩ dạng AxBy. (Ta phải tìm chỉ số x, y của A và B → Tìm tỉ lệ x : y → x, y). Trong hợp chất AxBy ta cĩ: mA = MA.x và mB = MB.y Theo bài ta cĩ tỉ lệ: oxitCTHH bM aM y x b a yM xM m m A B B A B A . . . . ( Tỉ lệ y x là số nguyên tối giản). 3. Bài tập vận dụng: Câu 1: Một oxit của nitơ cĩ tỉ lệ về khối lượng của nitơ đối với oxi là 7 : 20 . Tìm cơng thức của oxit ? Câu 2: Phân tích một oxit sắt người ta thấy cứ 7 phần khối lượng sắt thì cĩ 3 phần khối lượng oxi. Xác định cơng thức của oxit sắt ? Câu 3: Xác định cơng thức hĩa học của một oxit nhơm biết tỉ lệ khối lượng của 2 nguyên tố nhơm và oxi là 4,5 : 4. DẠNG 4: VIẾT PTHH VÀ HỒN THÀNH PTHH: Câu 1: Hồn thành những phản ứng hĩa học và cho biết mỗi phản ứng hĩa học sau thuộc loại phản ứng hố học nào ? a) . . . + . . . 0t MgO b) . . . + . . . 0t P2O5 c) . . . + . . . 0t Al2O3 d) . . . + . . . 0t Na2S e) H2O dp . . . + . . . f) KClO3 0t . . . + . . . g) . . . + . . . 0t CuCl2 h) KMnO4 0t K2MnO4 + MnO2 + . . . i) Mg + HCl . . . + . . . j) Al + H2SO4 . . . + . . . k) H2 + . . . 0t Cu + . . . l) CaO + H2O . . . Câu 2: Hồn thành các sơ đồ hố học sau: a) Na + H2O ? + ? b) KMnO4 ? + ? + ? c) ? + H2O H2SO3 d) Al + ? ? + H2 e) Ca2O + H2O ? + ? f) CuO + ? ? + Cu g) ? + H2O H2SO4 HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 9/ 13 Email: [email protected] h) Zn + ? ? + H2 i) Fe + ? FeSO4 + H2. j) Fe3O4 + ? Fe + H2O. k) KClO3 ? + ? l) P2O5 + H2O ? m) K2O + H2O ? . n) Fe2O3 + ? Fe2(SO4)3+H2O o) Al+ ? AlCl3 +H2 p) SO3 +H2O ? q) Fe + Cl2 FeCl3 r) H2 + Fe2O3 Fe + H2O s) KClO3 KCl + O2↑ t) Al + HCl AlCl3 + H2 u) K + O2 0t K2O v) Al + Br2 AlBr3 w) BaCl2 + AgNO3 Ba(NO3)2 + AgCl Câu 3: Hồn thành các phương trình hĩa học sau : a) Mg + HCl . . . + H2 b) . . . + H2O NaOH c) H2 + . . . H2O d) Cu + O2 . . . e) . . . + H2O . . . + H2 f) . . . + H2O Ba(OH)2 g) . . . + H2O H3PO4 h) . . . + H2 Cu + H2O i) Zn + HCl ZnCl2 + . . . j) Al + Fe2(SO4)3 + . . . k) Cr + . . . Cr2O3 l) ? + . . . 0t CuO m) Ca + O2 0t . . . n) Al + O2 0t . . . o) P + O2 ? p) CuCl2 + NaOH NaCl + . . . q) Zn + HCl ZnCl2 + . . . r) Al + Fe2(SO4)3 . . . + . . . s) P + O2 . . . t) Mg + . . . MgCl2 +. . . u) H2 + . . . Cu + . . . v) . . . +. . . Al2O3 Câu 4: Hồn thành các phương trình hĩa học sau o o 2 t 2 2 t 2 3 a. CaO + H O ... b. CO + ... Cu + ... c. Mg + ... MgCl + H d. Al + ... Al O o o 2 t 2 2 t e. BaO + H O ... f. C + ... Cu + ... g. Zn + ... ZnCl + H h. Mg + ... MgO HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 10/ 13 Email: [email protected] o o 2 2 t 2 2 2 t i. Na O + H O ... j. H + ... Cu + ... k. Fe + ... FeCl + H l. Zn + ... ZnO o o 2 2 t 2 2 t 2 m. K O + H O ... n. CO + ... Al + ... o. + ... MgCl + H p. Na + ... Na O Câu 5: Lập phương trình hố học của những phản ứng cĩ sơ đồ dưới đây: a) Al + ? Al2O3 b) Na2O + H2O NaOH c) CaO + H2O Ca(OH)2 d) SO3 + H2O ? e) P2O5 + H2O ? f) Na + H2O ? + ? g) Ba + H2O ? + ? h) Mg + O2 ? i) Na + H2O ? j) P2O5 + H2O ? k) H2O ? + ? l) KClO3 ? + ? m) Fe + CuSO4 ? + ? Câu 6: Hồn thành các phương trình hĩa học sau (ghi rõ điều kiện phản ứng nếu cĩ): a) Al + ? Al2O3 b) Fe + ? Fe3O4 c) P + O2 ? d) CH4 + O2 CO2 + H2O e) KMnO4 K2MnO4 + ? + ? f) KClO3 ? + ? g) Al + HCl AlCl3 + H2 Câu 7: Hồn thành các phương trình hĩa học sau (ghi rõ điều kiện phản ứng nếu cĩ): a) Cr + ? → Cr2(SO4)3 + H2 b) CuO + HCl → CuCl2 + H2O c) Fe2O3 + ? → FeCl3 + H2O d) Fe2O3 + H2SO4 → Fe2(SO4)3 + ? e) Zn + HCl → ? + H2O f) Zn(OH)2 + HCl → ZnCl2 + H2O g) Fe + ? → FeCl2 + H2O h) Al + HCl → AlCl3 + H2 i) H2 + Fe2O3 → Fe + H2O j) H2 + CuO → ? + ? k) CO + CuO → Cu + CO2 l) Fe3O4 + CO → ? + ? m) Fe + ? → FeCl2 + H2 n) ? + HCl → ZnCl2 + ? o) Al + Fe2O3 → ? + ? p) Al + H2SO4 → ? + ? Câu 8: Lập phương trình hố học của các phản ứng sau và cho biết các phản ứng trên thuộc loại phản ứng nào? a) Sắt (III) oxit + hiđro sắt + nước b) Lưu huỳnh trioxit + nước axit sunfuric c) Nhơm + sắt (III)oxit sắt + nhơm oxit HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 11/ 13 Email: [email protected] d) Canxi oxit + nước canxi hiđroxit e) Kali + nước kali hiđroxit + khí hiđro f) Kẽm + axit sufuric (lỗng) kẽm sunfat + khí hiđro DẠNG 5: NHẬN BIẾT THEO PHƢƠNG PHÁP HĨA HỌC Câu 1: Cĩ 3 bình đựng riêng biệt các chất khí: Khơng khí, O2, H2. Bằng cách nào nhận biết được các chất trong mỗi lọ. Câu 2: Cĩ 4 lọ mất nhãn đựng riêng biệt : dd axit HCl, dd bazơ NaOH, dd muối ăn NaCl, nƣớc cất. Bằng cách nào nhận biết được các chất trong mỗi lọ. Câu 3: Cĩ 3 bình đựng riêng biệt các dung dịch trong suốt sau: dd NaOH, dd axit HCl, dd Ca(OH)2. Bằng phương pháp hố học hãy nhận biết mỗi dung dịch đã cho? DẠNG 6: TỐN TÍNH THEO PHƢƠNG TRÌNH HĨA HỌC : 1. Tính số (n) mol theo khối lượng: )(mol M m n → Mnm . và n m M Trong đĩ: m là khối lượng chất. M là khối lượng mol. 2. Tính số mol theo thể tích chất khí ( V lít). )( 4,22 )( mol litV n → )(4,22. litnV Câu 1: Nhiệt phân hồn tồn 12,25g KClO3. Tính thể tích khí O2 ( ở đktc) thu được ? Câu 2: Muốn điều chế được 48 g O2 thì khối lượng KClO3 cần nhiệt phân là bao nhiêu g ? Câu 3: Muốn điều chế được 2,8 lít O2 (ở đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu ? Câu 4: Cho 32,5 gam kẽm tác dụng với dung dịch axit clohiđric dư. Tính thể tích khí hiđro sinh ra (đktc) và khối lượng lượng muối kẽm clorua tạo thành ? Câu 5: Cho nhơm kim loại tác dụng với dung dịch axit sunfuric (đủ). Biết cĩ 34,2 gam muối nhơm sunfat tạo thành. Tính lượng nhơm phản ứng và thể tích khí hiđro thu được (đktc)? Câu 6: Cho 5,4 gam nhơm phản ứng với dung dịch axit clohiđric (đủ) tạo thành muối nhơm clorua và khí hiđro. Tính thể tích khí hiđro thu được (đktc) và khối lượng muối nhơm clorua tạo thành ? Câu 7: Cho khí CO dư đi qua sắt (III) oxit nung nĩng thu được 11,2 gam sắt. Tính khối lượng sắt (III) oxit và thể tích khí CO đã phản ứng ? Câu 8: Oxi hĩa sắt ở nhiệt độ cao thu được oxit sắt từ Fe3O4. Tính số gam sắt và thể tích khí oxi cần dùng (đktc) để điều chế được 23,2 gam oxit sắt từ ? Câu 9: Trong phịng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hĩa sắt ở nhiệt độ cao. Để điều chế được 2,32g Fe3O4 cần dùng : a) Bao nhiêu gam sắt ? b) Bao nhiêu lít khí O2 ( ở đktc). c) Tính số gam kalipemanganat KMnO4 cần dùng để điều chế lượng khí oxi nĩi trên. Câu 10: Cho 11,2 gam sắt tác dụng với dd axit clohiđric dư tạo ra sắt (II) clorua và khí hiđro: a) Lập PTHH. b) Tính khối lượng axit clohiđric đã phản ứng. c) Tính thể tích khí hiđro sinh ra ở đktc. Câu 11: Cacbon cháy theo sơ đồ phản ứng: C + O2 0t CO2 a) Tính khối lượng của oxi cần dùng để đốt cháy hồn tồn 24g Cacbon. b) Tính thể tích khí CO2 tạo thành (ở đktc). Câu 12: Cho 4,8 g Mg tác dụng với dd HCl a) Lập PTHH. b) Tính thể tích khí thu được ở đktc. c) Tính khối lượng dd HCl tham gia PƯ. Câu 13: Khử 12 g Sắt (III) oxit bằng khí Hiđro. a) Tính thể tích khí Hiđro (ở đktc) cần dùng. b) Tính khối lượng sắt thu được sau phản ứng. Câu 14: Cho 19,5g Zn tác dụng với dung dịch axitsunfuric lỗng. HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 12/ 13 Email: [email protected] a) Tính khối lượng kẽm sunfat thu được sau phản ứng. b) Tính thể tích khí Hiđro thu được ở (đktc). c) Nếu dùng tồn bộ lượng hiđrơ bay ra ở trên đem khử 16g bột CuO ở nhiệt độ cao thì chất nào cịn dư? dư bao nhiêu gam? Câu 15: Hồ tan 7,2 g magie bằng dung dich axit clohiđric a) Thể tích khí H2 sinh ra (đktc)? b) Nếu dùng thể tích H2 trên để khử 19,2 g sắt (III) oxit thì thu được bao nhiêu gam sắt? Câu 16: Cho 60,5 g hỗn hợp gồm hai kim loại Zn và Fe tác dụng với dung dịch axit clohđric. Thành phần phần trăm của sắt trong hỗn hợp là 46,28%. Hãy xác định: a) Khối lượng mỗi kim loại trong hỗn hợp? b) Thể tích khí H2 sinh ra (ở đktc). c) Khối lượng các muối tạo thành sau phản ứng . Câu 17: Cho 22,4 g sắt tác dụng với dd H2SO4 lỗng chứa 24,5 g H2SO4 a) Tính thể tích khí H2 thu được ở đktc? b) Chất nào thừa sau phản ứng và thừa bao nhiêu gam? Câu 18: Đốt cháy 2,8 lit khí hiđro trong khơng khí a) Tính thể tích và khối lượng của khí oxi cần dùng? b) Tính khối lượng nước thu được (Thể tích các khí đo ở đktc). Câu 19: Cho 22,4 lit khí hiđro tác dung với 16,8 lit khí oxi. Tính khối nước thu được. (các khí đo ở đktc). Câu 20: Khử hồn tồn 48 gam đồng (II) oxit bằng khí H2 ở nhiệt độ cao a) Tính số gam đồng kim loại thu được? b) Tính thể tích khí H2 (đktc) cần dùng? Câu 21: Cho một hỗn hợp chứa 4,6 g natri và 3,9 g kali tác dụng với nước . a) Tính thể tích khí hiđro thu được (đktc ) ? b) Tính nồng độ phần trăm của dung dịch biết khối lượng nước là 91,5 g? Câu 22: Trong phịng thí nghiệm người ta điều chế khí Hiđro bằng cách cho 97,5g kẽm tác dụng với dung dịch Axit clohiđric vừa đủ . a) Viết phương trình hố học của phản ứng xảy ra . b) Tính thể tích khí Hiđro thu được (ở đktc). c) Dẫn tồn bộ lượng khí sinh ra bột đồng (II) oxit dư đun nĩng. Tính lượng đồng kim loại tạo thành . Câu 23: Cho 0,54g Al tác dụng với dung dịch HCl . a) Viết phương trình phản ứng xảy ra. b) Khối lượng đồng tạo thành là bao nhiêu gam? c) Tính thể tích khí hidro thu được (ở đktc). Câu 24: Cho sơ đồ phản ứng: Al + HCl AlCl3 + H2 a) Hồn thành sơ đồ phản ứng trên. b) Nếu cĩ 10,8 gam nhơm đã phản ứng thì thu được bao nhiêu lít khí hidro (ở đktc)? c) Tính khối lượng muối tạo thành ? DẠNG 7: BÀI TỐN VỀ LƢỢNG CHẤT DƢ. (Bài cho đồng thời cả 2 lượng chất tham gia phản ứng). Phương pháp giải: Tìm chất dư, chất hết → Tính theo chất hết. - Bước 1: Tính số mol mỗi chất. - Bước 2: Viết phương trình phản ứng: A + B → C + D - Bước 3: Lập tỉ lệ So sánh: ( ) ( . ) A A n Bàicho n Ph trình so với ( ) ( . ) B B n Bàicho n Ph trình Tỉ số nào lớn hơn chất đĩ dư, chất kia hết → Tính theo chất hết. Ví dụ: Cho 32,5 gam kẽm tác dụng với 47,45 gam axit clohiđric. a. Tính thể tích khí hiđro sinh ra (đktc) ? b. Tính khối lượng muối kẽm clorua tạo thành ? Bài làm: HĨA HỌC 8 www.dangnhatlong.com Biên soạn : Đặng Nhật Long Trang 13/ 13 Email: [email protected] - Số mol các chất tham gia phản ứng: )(5,0 65 5,32 mol M m n Zn Zn Zn )(3,1 5,36 45,47 mol M m n HCl HCl HCl - Phương trình phản ứng: Zn + 2HCl → ZnCl2 + H2 - Xét tỉ lệ: ( ) ( )0,5 1,3 ( . ) 1 2 ( . ) Zn HCl Zn HCl n Bàicho n Bàicho n Ph trình n Ph trình → Axit HCl dư, kim loại Zn hết. → Tính theo Zn. a. Theo phương trình phản ứng ta cĩ: )(5,0 2 molnn ZnH → )(2,114,22.5,04,22. 22 lítnV HH b. Theo phương trình phản ứng ta cĩ: )(5,0 2 molnn ZnZnCl → )(68136.5,0. 222 gamMnm ZnClZnClZnCl Bài tập vận dụng: Câu 1: Cho 5,4 gam nhơm tác dụng với 36,5 gam axit clohiđric tạo thành khí hiđro và muối nhơm clorua. a. Tính thể tích khí hiđro thu được (đktc) ? b. Tính khối lượng muối nhơm clorua tạo thành ? Câu 2: Cho 7,2 gam sắt (II) oxit tác dụng với dung dịch cĩ chứa 0,4 mol axit clohiđric thu được muối sắt (II) clorua và nước. a. Viết phương trình hĩa học của phản ứng xảy ra ? b. Tính khối lượng muối sắt (II) clorua tạo thành ? Câu 3: Cho 8,1 gam nhơm tác dụng với 29,4 gam axit sunfuric thu được khí hiđro và muối nhơm sunfat. a. Tính thể tích khí hiđro thu được (đktc) ? b. Tính khối lượng muối nhơm sunfat tạo thành ? Câu 4: Dẫn 11,2 lít khí CO (đktc) qua 16 gam sắt (III) oxit nung nĩng thu được kim loại sắt và khí CO2 a. Tính thể tích khí CO phản ứng (đktc) ? b. Tính khối lượng Fe sinh ra ? Câu 5: Cho 1,68 lít khí CO2 (đktc) vào dung dịch chứa 3,7 gam Ca(OH)2 tạo thành kết tủa CaCO3(↓) và nước. Xác định lượng kết tủa CaCO3 thu được ?
Tài liệu đính kèm:
 KIEN_THUC_TONG_QUATHOC_KI_II_HOA_HOC_8.pdf
KIEN_THUC_TONG_QUATHOC_KI_II_HOA_HOC_8.pdf





