Chuyên đề: Nhóm Halogen và hợp chất của chúng
Bạn đang xem tài liệu "Chuyên đề: Nhóm Halogen và hợp chất của chúng", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
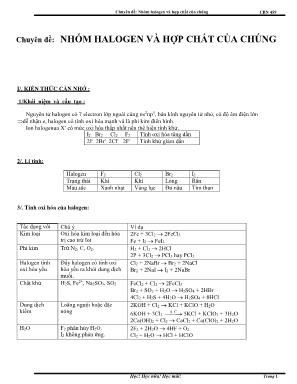
Chuyên đề: Nhĩm halogen và hợp chất của chúng CBN 459 Học! Học nữa! Học mãi! Trang 1 Chuyên đề: NHĨM HALOGEN VÀ HỢP CHẤT CỦA CHÚNG I/. KIẾN THỨC CẦN NHỚ : 1/Khái niệm và cấu tạo : Nguyên tử halogen cĩ 7 electron lớp ngồi cùng ns2np5, bán kính nguyên tử nhỏ, cĩ độ âm điện lớn dễ nhận e, halogen cĩ tính oxi hĩa mạnh và là phi kim điển hình. Ion halogenua X- cĩ mức oxi hĩa thấp nhất nên thể hiện tính khử. I2 Br2 Cl2 F2 Tính oxi hĩa tăng dần 2I- 2Br- 2Cl- 2F- Tính khử giảm dần 2/. Lí tính: Halogen F2 Cl2 Br2 I2 Trạng thái Khí Khí Lỏng Rắn Màu sắc Xanh nhạt Vàng lục Đỏ nâu Tím than 3/. Tính oxi hĩa của halogen: Tác dụng với Chú ý Ví dụ Kim loại Oxi hĩa kim loại đến hĩa trị cao trừ Iot 2Fe + 3Cl2 2FeCl3 Fe + I2 FeI2 Phi kim Trừ N2, C, O2. H2 + Cl2 2HCl 2P + 3Cl2 PCl3 hay PCl5 Halogen tính oxi hĩa yếu Đẩy halogen cĩ tính oxi hĩa yếu ra khỏi dung dịch muối. Cl2 + 2NaBr Br2 + 2NaCl Br2 + 2NaI I2 + 2NaBr Chất khử H2S, Fe2+, Na2SO3, SO2 FeCl2 + Cl2 2FeCl3 Br2 + SO2 + H2O H2SO4 + 2HBr 4Cl2 + H2S + 4H2O H2SO4 + 8HCl Dung dịch kiềm Lỗng nguội hoặc đặc nĩng 2KOH + Cl2 KCl + KClO + H2O 6KOH + 3Cl2 đ , t 5KCl + KClO3 + 3H2O o 2Ca(OH)2 + Cl2 CaCl2 + Ca(ClO)2 + 2H2O H2O F2 phân hủy H2O. I2 khơng phản ứng. 2F2 + 2H2O 4HF + O2 Cl2 + H2O HCl + HClO Chuyên đề: Nhĩm halogen và hợp chất của chúng CBN 459 Học! Học nữa! Học mãi! Trang 2 4/. Tính chất hĩa học của các Halogenua: a/. Các phản ứng của halogen và axit HX Tính chất HF HCl HBr HI Tính axit của dd HX Yếu Mạnh Mạnh hơn HCl Mạnh hơn HBr T/d với dd AgNO3 AgF tan AgCl trắng AgBr vàng nhạt AgI vàng T/d với SiO2 SiO2 + 4HF SiF4 + 2H2O Khơng phản ứng T/d với O2 Khơng phản ứng Pư ở thể khí cĩ xt 4HCl+O2 2H2O+Cl2 Dd HX t/d với O2 của khơng khí: 4HX + O2 2H2O + 2X2 T/d với H2SO4 đặc Khơng phản ứng 2HBr + H2SO4 Br2 + SO2 + 2H2O 8HI + H2SO4 4I2 + H2S + 4H2O Nhận xét HF HCl HBr HI Tính axit tăng dần, tính khử tăng dần Điều chế và sản xuất CaF2 + H2SO4 CaSO4 + 2HF * NaCl(r)+ H2SO4(đặc) NaHSO4 +2HCl(k) * H2 + Cl2 2HCl * R–H +Cl2RCl+HCl PX3 + 3H2OH3PO3 + 3HX Thực tế: 3X2 + 2P + 6H2O 2H3PO3 + 6HX b/. Dựa vào tính khử của X- ta cĩ phương pháp điểu chế halogen Các phản ứng Flo (F2) Clo (Cl2) Brom (Br2) Iot (I2) Trong PTN khơng điều chế Cho dung dịch HX đặc t/d với chất oxi hĩa (MnO2, KClO3, KMnO4) MnO2 + 4HX MnX2 + X2 + 2H2O Trong CN Điện phân hh lỏng gồm KF và HF 2HF H2 + F2 Điện phân dd NaCl cĩ màng ngăn 2NaCl + 2H2O H2 + Cl2 + 2NaOH Sau phơi nước biển lấy NaCl, cịn NaBr Cl2 + 2NaBr 2NaCl+Br2 Rong biển khơ đem đốt tạo tro + H2O dd NaI Cl2+2NaI 2NaCl+I2 Chuyên đề: Nhĩm halogen và hợp chất của chúng CBN 459 Học! Học nữa! Học mãi! Trang 3 AgNO3 - - - - AgCl (trắng) AgBr (vàng nhạt) AgI (vàng) AgF tan 3 2 2 3 2 4 2 7 2 5/. Hợp chất chứa oxi của clo: Trong hợp chất, clo cĩ nhiều số oxi hĩa khác nhau, chủ yếu là các số oxi hĩa lẻ (-1, +1, +3, +5, +7). a/. Nước Javen : Là dung dịch thu được khi cho khí clo qua dung dịch NaOH 2NaOH + Cl2 NaCl + NaClO + H2O Nước Javen cĩ tính oxi hĩa mạnh dùng để tẩy trắng, sát trùng. NaClO là muối của axit yếu, trong khơng khí tác dụng vĩi khí CO2 tạo dung dịch axit hipoclorơ là axit kém bền và cĩ tính oxi hĩa mạnh. NaClO + CO2 + H2O NaHCO3 + HClO b/. Clorua vơi: Cơng thức cấu tạo: Cl – Ca – O – Cl Chất bột màu trắng của muối clo, được điều chế bằng cách cho khí clo tác dụng với vơi sữa Cl2 + Ca(OH)2 CaOCl2 + H2O CaOCl2 là muối của 2 axit: HClO và HCl. Trong khơng khí, clorua vơi tác dụng với CO2 tạo dung dịch axit hipoclorơ là axit kém bền cĩ tính oxi hĩa mạnh. 2CaOCl2 + CO2 + H2O CaCO3 + CaC2 + 2HClO c/. Kali clorat: Tinh thể màu trắng, được điều chế bằng cách cho khí clo qua dd KOH dư nhiệt độ khoảng 70oC 6KOH + 3Cl đ, to 5KCl + KClO + 3H O Nhiệt phân KClO3 cĩ xúc tác MnO2, phản ứng dễ dàng: 2KClO t o 2KCl + 3O d/. Các axit Clorua Oxi của clo: Các axit clorua oxi của clo gồm: axit hipoclorơ HClO, axit clorơ HClO2, axit clorit HClO3, axit peclorit HClO4. Tính axit trong dung dịch tăng dần và tính oxi hĩa giảm dần lần lượt là: HClO, HClO2, HClO3, HClO4. HClO: axit yếu kém bền : NaClO + CO2 + H2O NaHCO3 + HClO 2HClO 2HCl + O2 HClO2: axit trung bình, kém bền: 3HClO2 2HClO3 + HCl HClO3: axit mạnh, kém bền khi nồng độ > 50% 3HClO3 HClO4 + ClO2 + H2O HClO4: axit bền nhất trong trong các axit vơ cơ, kém bền khi nung với P2O5 2HClO t o Cl O + H O 6/. Giải tốn liên quan đến halogen: a/. Nhận biết X- bằng dd AgNO3 Cl Br I F Riêng I- sau khi oxi hố bằng Fe3+: 2Fe3+ + 2I- 2Fe2+ + I2 Iot sinh ra làm hồ tinh bột cĩ màu xanh thẫm. b/. Các halogen X2 (trong dung dịch) khi cơ cạn sẽ bị bay hơi . Chú ý: + 2 muối halogenua tác dụng với AgNO3 cĩ tạo kết tủa (cĩ thể 2 hoặc 1 muối tạo kết tủa) + Cho halogen X tác dụng với muối halogenua NaY, cĩ thể gặp trường hợp X2 thiếu, Y2 bị đẩy ra khơng hồn tồn Chuyên đề: Nhĩm halogen và hợp chất của chúng CBN 459 Học! Học nữa! Học mãi! Trang 4 III/. BÀI TẬP ỨNG DỤNG: ĐỀ 1: Câu 1: Hịan thành chuỗi phản ứng sau (ghi rõ điều kiện nếu cĩ) Natri clorua →Clo →sắt (III) clorua →sắt (III) nitrat →sắt (III) hiđroxit Brom →hiđro bromua →bạc bromua →Brom Câu 2: Bổ túc và cân bằng phương trình phản ứng Cl2 + ? →HCl NaI + ? → NaBr + ? Cl2 + ? → nuớc javen Fe(OH)2 + HCl → ? + ? MnO2 + ? → Cl2 + ? + ? Br2 + ? → HBrO + ? Câu 3: Viết phương trình phản ứng: a) chứng minh NaClO là muối của axit rất yếu, yếu hơn cả axít cacbonic (1 phương trình). b) chứng minh Clo vừa cĩ tính oxi hĩa, vừa cĩ tính khử (2 phương trình). Câu 4: Cho hỗn hợp gồm 27,2 gam hỗn hợp Fe và Fe2O3 tác dụng với 500g dung dịch HCl thu đuợc 57,9 gam muối. a) Tính % khối luợng các chất trong hỗn hợp đầu. b) Tính C% của dd HCl cần dung. Câu 5: Chỉ dùng một thuốc thử duy nhất, hãy nhận biết các dung dịch sau : BaCl2, Zn(NO3)2, NaNO3, AgNO3, HBr. Câu 6: Cho 31,84 gam hỗn hợp NaX, NaY ( X, Y là hai halogen ở hai chu kì liên tiếp ) vào dung dịch AgNO3 cĩ dư thu được 57,34 gam kết tủa. Tìm cơng thức của NaX, NaY và tính khối lượng mỗi muối. ĐỀ 2: Câu 1: Viết phương trình phản ứng so sánh tính oxi hĩa của Flo, Clo, Brom, Iot và rút ra kết luận về tính oxi hĩa của chúng. Câu 2 : Bằng phương pháp hĩa học phân biệt các dung dịch sau : NaBr , Na2SO4 , KNO3 , Na2CO3 Câu 3 : Từ muối ăn , H2O điều chế nước Javen Câu 4: Bổ túc và cân bằng phương trình phản ứng Fe + ? FeCl3 Cl2 + ? Br2 + ? NaClO + ? + ? HClO + ? MgCO3 + ? CO2 + ? + ? KMnO4 + ? KCl + ? + ? +? SiO2 + ? H2O + ? Câu 5: Cho 12,6 gam hỗn hợp Al và FeO tác dụng với 200ml dd HCl thu được 39,4 gam muối. a. Tính % về khốii luợng các chất trong hỗn hợp đầu. b. Tính CM của các muối thu đuợc (Coi thể tích dd thay đổi khơng đáng kể) Câu 6: Cho lượng dư dung dịch AgNO3 tác dụng với hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là bao nhiêu gam Bài tập trắc nghiệm: Câu 1: Cho các axit : HCl(1);HI(2);HBr(3).Sắp xếp theo chiều tính khử giảm dần: A.(1)>(2)>(3) B.(3)>(2)>(1) C.(1)>(3)>(2) D.(2)>(3)>(1) Câu 2: Tính oxi hố của các halogen giảm dần theo thứ tự sau: A. Cl2 > Br2 >I2 >F2 B. F2 > Cl2 >Br2 >I2 C. Br2 > F2 >I2 >Cl2 D. I2 > Br2 >Cl2 >F2 Câu 3: Số oxy hố của clo trong các chất: HCl, KClO3, HClO, HClO2, HClO4 lần lượt là: A. +1, +5, -1, +3, +7 B. -1, +5, +1, -3, -7 C. -1, -5, -1, -3, -7 D. -1, +5, +1, +3, +7 Câu 4: Các nguyên tố phân nhĩm chính nhĩm VIIA cĩ cấu hình electron lớp ngồi cùng là: A. 3s2 3p5 B. 2s2 2p5 C. 4s2 4p5 D. ns2 np5 Câu 5: Thêm dần nước Clo vào dung dịch KI cĩ chứa sẵn một ít hồ tinh bột . Hiện tượng quan sát được là : A.dd hiện màu xanh . B. dd hiện màu vàng lục C. Cĩ kết tủa màu trắng D. Cĩ kết tủa màu vàng nhạt . Câu 6: Chất tác dụng với H2O tạo ra khí oxi là: A. Flo B. Clo C. Brom D. Iot Chuyên đề: Nhĩm halogen và hợp chất của chúng CBN 459 Học! Học nữa! Học mãi! Trang 5 Câu 7: Dãy khí nào sau đây ( từng chất một) làm nhạt được màu của dung dịch nước brom. A. CO2, SO2, N2, H2S. B. SO2, H2S. C. H2S, SO2, N2, NO. D. CO2, SO2, NO2. Câu 8: Cĩ 3 dung dịch NaOH, HCl, H2SO4 lỗng. Thuốc thử duy nhất để phân biệt 3 dd là: A. BaCO3 B. AgNO3 C.Cu(NO3)2 D. AgNO3 Câu 9: Thuốc thử đặc trưng để nhận biết ra hợp chất halogenua trong dung dịch là: A. AgNO3 B. Ba(OH)2 C. NaOH D. Ba(NO3)2 Câu 10: Cho 87g MnO2 tác dụng hết với dd HCl đặc, nĩng thu bao nhiêu lít khí clo(đktc) là (Mn=55; O=16) A. 4,48lít. B. 2.24lít. C. 22.4lít. D. 44.8lít. Câu 11: Cho 10 gam dd HCl tác dụng với dd AgNO3 dư thu được 14,35g kết tủa. C% của dd HCl phản ứng là: A. 35.0 B. 50.0 C.15.0 D. 36.5 Câu 12: Cho hỗn hợp A gồm Fe và Mg vào dung dịch HCl vừa đủ thì được 4,48lít H2 (đktc). Mặt khác A tác dụng vừa đủ với 5,6lít clo (đktc). % khối lượng Mg trong A là ( Fe=56 và Mg = 24) A. 57%. B. 70%. C. 43%. D. 30%. Câu 13: Hồ tan hỗn hợp CaO và CaCO3 bằng dung dịch HCl dư , ta thu được dung dịch A và 0,448 lit khí CO2 (ở đktc). Cơ cạn dung dịch A ta thu được 3,33g muối khan. Số gam mỗi chất trong hỗn hợp ban đầu lần lượt là: A. 0,28g ; 0,2g B. 2,8g ; 2g C. 5,6g ; 20g D. 0,56g ; 2,0g Câu 14*: Sắp xếp nào sau đây theo chiều tăng dần tính axit: A. HClO > HClO2 > HClO3 > HClO4 B.HClO < HClO2 < HClO3 < HClO4 C. .HClO3 HClO4 > HClO > HClO2 Câu 15: Cho 15,8g KMnO4 tác dụng hồn tồn với dung dịch HCl đặc,dư. Thể tích khí thu được ở đktc là : A. 4,8 lít B. 5,6 lít C. 0,56 lít D. 8,96 lít Câu 16: Cĩ 5 gĩi bột tương tự nhau là CuO, FeO, MnO2, Ag2O, Fe . Cĩ thể dùng dung dịch nào trong các dung dịch nào dưới đây để phân biệt 5 chất trên? A. HNO3 B. AgNO3 C. HCl D. Ba(OH)2 Câu 17: Hồ tan 12,8 gam hỗn hợp gồm Fe và FeO bằng dung dịch HCl 0,1M vừa đủ, thu được 2,24lít khí (đktc). Thể tích dung dịch HCl đã dùng là : A. 2,0 lít B. 4,2 lít C. 4,0 lít D. 14,2 lít Câu 18: Hồ tan hồn tồn104,25 gam hỗn hợp X gồm NaCl và NaI vào nước được dung dịch A. Sục khí clo dư vào dung dịch A. Kết thúc thí nghiệm, cơ cạn dung dịch, thu được 58,5g muối khan. khối lượng NaCl cĩ trong hỗn hợp X là: A. 17,55g B. 29,25g C. 58,5g D. Cả A, B, C đều sai Câu 19: Hồ tan hồn tồn 7,8g hỗn hợp Mg và Al bằng dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7,0 gam so với ban đầu. Số mol axit đã tham gia phản ứng là : A. 0,8 mol B. 0,08 mol C. 0,04 mol D. 0,4 mol Câu 20: Cho 31,84 gam hỗn hợp NaX và NaY (X, Y là 2 halogen ở hai chu kỳ liên tiếp) vào dung dịch AgNO3 dư thu được 57,34 g kết tủa. Cơng thức của 2 muối là: A. NaCl và NaBr B. NaBr và NaI C. NaF và NaCl D. NaF và NaCl hoặc NaBr và NaI Câu 21: Hồ tan hồn tồn 20g hỗn hợp Mg và Fe bằng dung dịch axit HCl dư, sau phản ứng thu được 11,2 lít khí (đktc) và dung dịch X.Cơ cạn X thu được bao nhiêu gam muối khan? A. 55,5 B. 91,0 C. 90,0 D. 71,0 Câu 22: Cho 1 lít hỗn hợp các khí H2, Cl2, HCl đi qua dung dịch KI, thu được 2,54g iot và khí đi ra khỏi dung dịch cĩ thể tích là 500ml (các khí đo ở điều kiện PƯ). Thành phần phần trăm theo số mol hỗn hợp khí (H2, Cl2, HCl)lần lượt là : A. 50; 22,4; 27,6 B. 25; 50, 25 C. 21; 34,5; 44,5 D. 47,5; 22,5; 30 Câu 23: Dẫn 2 luồng khí clo đi qua 2 dung dịch KOH: dung dịch thứ nhất lỗng và nguội, dung dịch thứ 2 đậm đặc và đun nĩng ở 100˚C. Nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỷ lệ thể tích khí clo đi qua dung dịch KOH thứ nhất/ dung dịch thứ 2 là: A. 1/3 B. 2/4 C. 4/4 D. 5/3 Câu 24: Hồ tan 8,075g hỗn hợp A gồm NaX và NaY (X, Y là hai halogen kế tiếp) vào nước. Dung dịch thu được cho phản ứng vừa đủ với dung dịch AgNO3 thu được 16,575g kết tủa. Phần trăm khối lượng của NaX và NaY tương ứng là A. 36,22% ; 63,88% B. 35,45%; 64,55% C. 35%; 65% D. 34, 24%; 65,76% Chuyên đề: Nhĩm halogen và hợp chất của chúng CBN 459 Học! Học nữa! Học mãi! Trang 6 Câu 25: (CĐ – Khối A – 2009) Chất dùng để làm khơ khí Cl2 ẩm là A. dung dịch H2SO4 đậm đặc . B. Na2SO4 khan. C. dung dịch NaOH đặc. D. CaO . Câu 26: (ĐH – khối A – 2009). Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là: A. KMnO4. B. MnO2. C. CaOCl2. D. K2Cr2O7. Câu 27: Cho m gam đơn chất halogen X2 tác dụng với Mg dư thu được 19g muối. Cũng m gam X2 cho tác dụng với Al dư thu được 17,8g muối. X là A. Flo. B. Clo. C. Iot. D. Brom. Câu 28: (ĐH – Khối B – 2007) Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhĩm IIA (phân nhĩm chính nhĩm II) tác dụng hết với dung dịch HCl (dư), thốt ra 0,672 lít khí H2 (ở đktc). Hai kim loại đĩ là (cho Be = 9, Mg = 24, Ca = 40, Sr = 87, Ba = 137) A. Ca và Sr. B. Sr và Ba. C. Mg và Ca. D. Be và Mg. Câu 29: (ĐH – Khối A – 2009). Dãy gồm các chất đều tác dụng được với dung dịch HCl lỗng là A. Mg(HCO3)2, HCOONa, CuO. B. AgNO3, (NH4)2CO3, CuS. C. KNO3, CaCO3, Fe(OH)3. D. FeS, BaSO4, KOH. Câu 30: (ĐH – B – 2007). Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dung dịch KOH ở . Sau khi phản ứng xảy ra hồn tồn, thu được 37,25 gam KCl. Dung dịch KOH trên cĩ nồng độ là A. 0,48M. B. 0,24M. C. 0,4M. D. 0,2M. Câu 31: (ĐH – khối A – 2009). Hịa tan hồn tồn 14,6 gam hỗn hợp X gồm Al và Sn bằng dung dịch HCl (dư), thu được 5,6 lít khí H2 (ở đktc). Thể tích khí O2 (ở đktc) cần để phản ứng hồn tồn với 14,6 gam hỗn hợp X là: A. 2,80 lít. B. 1,68 lít. C. 4,48 lít. D. 3,92 lít. Câu 32: (CĐ – Khối A – 2009) Chất dùng để làm khơ khí Cl2 ẩm là A. dung dịch H2SO4 đậm đặc . B. Na2SO4 khan. C. dung dịch NaOH đặc. D. CaO . Câu 33: (ĐH – Khối A – 2008). Để oxi hĩa hồn tồn 0,01 mol CrCl3 thành K2CrO4 bằng Cl2 khi cĩ mặt KOH, lượng tối thiểu Cl2 và KOH tương ứng là A. 0,03 mol và 0,08 mol. B. 0,03 mol và 0,04 mol. C. 0,015 mol và 0,08 mol. D. 0,015 mol và 0,04 mol. Câu 34: (ĐH – khối A – 2009). Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là: A. KMnO4. B. MnO2. C. CaOCl2. D. K2Cr2O7. Câu 35: Cho hỗn hợp MgO và MgCO3 tác dụng với dung dịch HCl 20% thì thu được 6,72 lít khí (đktc) và 38 gam muối. Thành phần phần trăm của MgO và MgCO3 là: A. 27,3% và 72,7%. B. 25% và 75%. C. 13,7% và 86,3%. D. 55,5% và 44,5%. Good luck!
Tài liệu đính kèm:
 Chuyen_de_halogen_full_ly_thuyet_bai_tap.pdf
Chuyen_de_halogen_full_ly_thuyet_bai_tap.pdf





