Tuyển tập Đề thi học sinh giỏi Hóa học lớp 9 - Đề 42
Bạn đang xem tài liệu "Tuyển tập Đề thi học sinh giỏi Hóa học lớp 9 - Đề 42", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
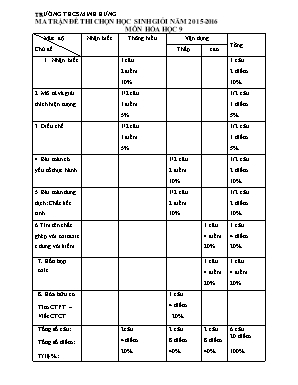
TRƯỜNG THCS MINH HƯNG MA TRẬN ĐỀ THI CHỌN HỌC SINH GIỎI NĂM 2015-2016 MƠN HÓA HỌC 9 Mức độ Chủ đề Nhận biết Thơng hiểu Vận dụng Tổng Thấp cao Nhận biết 1 câu 2 điểm 10% 1 câu 2 điểm 10% 2. Mơ tả và giải thích hiện tượng 1/2 câu 1 điểm 5% 1/2 câu 1 điểm 5% 3. Điều chế 1/2 câu 1 điểm 5% 1/2 câu 1 điểm 5% 4. Bài tốn cĩ yếu tố thực hành 1/2 câu 2 điểm 10% 1/2 câu 2 điểm 10% 5. Bài tốn dung dịch: Chất kết tinh 1/2 câu 2 điểm 10% 1/2 câu 2 điểm 10% 6.Tìm tên chất ghép với oxitaxit t.dung với kiềm 1 câu 4 điểm 20% 1 câu 4 điểm 20% 7. Hỗn hợp oxit 1 câu 4 điểm 20% 1 câu 4 điểm 20% 8. Hĩa hữu cơ Tìm CTPT – Viết CTCT 1 câu 4 điểm 20% Tổng số câu: Tổng số điểm: Tỉ lệ %: 2câu 4 điểm 20% 2 câu 8 điểm 40% 2 câu 8 điểm 40% 6 câu 20 điểm 100% PHỊNG GD – ĐT BÙ ĐĂNG KÌ THI CHỌN HỌC SINH GIỎI LỚP 9 TRƯỜNG THCS MINH HƯNG Năm học 2015 – 2016 ĐỀ THI ĐỀ XUẤT (Đề thi gồm 02 trang) ĐỀ THI MƠN: HĨA HỌC Thời gian làm bài: 150 phút (Khơng kể thời gian phát đề) Câu 1(2 điểm): Bằng phương pháp hố học làm thế nào để nhận ra sự cĩ mặt của mỗi khí trong hỗn hợp gồm: CO, CO2, SO2, SO3. Viết phương trình phản ứng. Câu 2 (2 điểm): a. Hãy nêu các hiện tượng xảy ra và giải thích bằng phương trình phản ứng trong thí nghiệm sau: Dẫn từ từ CO2 vào dung dịch nước vơi trong cho tới dư, sau đĩ cho tiếp nước vơi trong dư vào dung dịch vừa thu được. b. Trình bày phương pháp điều chế CaSO4, FeCl3, H2SiO3 từ hỗn hợp CaCO3, Fe2O3, SiO2 Câu 3 (4 điểm): Trên hai đĩa cân đặt hai cốc dung dịch HCl và H 2SO4 lỗng cĩ khối lượng bằng nhau – cân thăng bằng. - Cho vào cốc đựng dung dịch HCl 25 gam CaCO3 - Cho vào cốc đựng dung dịch H2SO4 (a) gam Al Sau khi phản ứng kết thúc, cân vẫn giữ vị trí thăng bằng. Hãy tính (a), biết các phản ứng xảy ra hồn tồn. 2. Cần hòa tan bao nhiêu gam tinh thể CuSO4.5H2O vào 200g dung dịch CuSO4 4% để được dung dịch CuSO4 có nồng độ 14%. Câu 4 (4 điểm): Cho luồng khí CO đi qua một ống sứ chứa m gam bột sắt oxit ( FexOy) nung nĩng cho đến khi phản ứng xảy ra hồn tồn. Dẫn tồn bộ lượng khí sinh ra đi thật chậm vào 1 lít dung dịch Ba(OH)2 0,1M thu được 9,85 gam kết tủa. Mặt khác, khi hồ tan tồn bộ lượng kim loại sắt tạo thành ở trên bằng V lít dung dich HCl 2M (cĩ dư) thì thu được một dung dịch, sau khi cơ cạn thu được 12,7 gam muối khan. Xác định cơng thức sắt oxit Tính m Câu 5(4 điểm): Cho hỗn hợp A gồm 3 oxit: Al2O3, CuO, K2O. Tiến hành 3 thí nghiệm: Thí nghiệm 1: Nếu cho hỗn hợp A vào nước dư, khuấy kĩ thấy cịn 15 gam chất rắn khơng tan. Thí nghiệm 2: Nếu cho thêm vào hỗn hợp A một lượng Al2O3 bằng 50% lượng Al2O3 trong A ban đầu rồi lại hồ tan vào nước dư. Sau thí nghiệm cịn lại 21 gam chất rắn khơng tan. Thí nghiệm 3: Nếu cho vào hỗn hợp A một lượng Al2O3 bằng 75% lượng Al2O3 trong A, rồi lại hồ tan vào nước dư, thấy cịn lại 25 gam chất rắn khơng tan. Tính khối lượng mỗi oxit trong hỗn hợp A. Câu 6(4 điểm): Đốt cháy hồn tồn 2,24 lít ở đktc một hiđrocacbon A ở thể khí. Sau đĩ dẫn sản phẩm cháy qua bình đựng 4 lít dung dịch Ca(OH)2 0,05M thấy cĩ 10 gam kết tủa. Khối lượng bình tăng là 18,6 gam. Tìm cơng thức phân tử của A Viết các cơng thức cấu tạo cĩ thể cĩ của A. .......................... Hết ĐÁP ÁN: MƠN HĨA HỌC Câu 1(2 điểm): Dẫn qua dd BaCl2 nếu cĩ kết tủa trắng thì nhận được SO3 (0,5 điểm) SO3 + H2O + BaCl2 BaSO4 + 2HCl Và 3 khí cịn lại tiếp tuc dẫn qua dd Br2 nếu Br2 mất màu thì nhận được SO2 SO2 + H2O + Br2 H2SO4 + 2HBr (0,5 điểm) Và 2 khí cịn lại tiếp tuc dẫn qua nước vơi trong dư nếu vẩn đục thì nhận được CO2 (0,5 điểm) CO2 + Ca(OH)2 CaCO3 + H2O Khí cịn lại khơng bị hấp thụ đem dẫn qua CuO nĩng thấy CuO (đen) + CO Cu (đỏ) + CO2 (0,5 điểm) Hấp thụ sản phẩm khí bằng nước vơi trong cĩ vẩ đục là nhận được CO Câu 2: (2 điểm) 1. ( 1 điểm ) - Nước vơi trong đục dần, kết tủa trắng tăng dần đến tối đa ( max). (0,25 điểm) Ca(OH)2 + CO2 CaCO3 + H2O (1) - Sau một thời gian kết tủa tan trở lại, sau cùng trong suốt. (0,25 điểm) CaCO3 + CO2 dư + H2O = Ca(HCO3 )2 (2) - Cho tiếp dd Ca(OH)2 vào dd vừa thu được. Dung dịch lại đục ,kết tủa trắng xuất hiện trở lại, sau thời gian cĩ tách lớp. (0,25 điểm) Ca(HCO3)2 + Ca(OH)2 2CaCO3 + 2H2O (3) (0,25 điểm) (1 điểm) - Sục CO2 vào hỗn hợp, ta được Ca(HCO3)2 tan (0,25 điểm) CaCO3 + CO2 + H2O Ca(HCO3 )2 - Lọc và lấy nước lọc tác dụng với H2SO4 đặc ta cĩ: (0,25 điểm) H2SO4 + Ca(HCO3 )2 CaSO4 + CO2 + H2O - Ngâm chất rắn khơng tan trong dd HCl (0,25 điểm) Fe2O3 + 6 HCl 2FeCl3 + 3H2O Lọc tách SiO2 và cơ cạn dd thì được FeCl3. - Hồ tan SiO2 bằng NaOH đặc, đun nĩng (0,25 điểm) SiO2 + 2NaOH Na2SiO3 + H2O Cho HCl vào thì được H2SiO3 kết tủa 2HCl + Na2SiO32NaCl + H2SiO3 Câu 3: (4 điểm) 1.(2 điểm) -Cốc thứ nhất: sau khi CO2 bay đi, khối lượng tăng thêm: (1điểm) Số mol CaCO3 = 25/100 = 0,25 mol CaCO3 + 2HCl CaCl2 + CO2 + H2O 0,25 0,25 25 – 0,25.44 = 14 gam - Để cân thăng bằng, ở cốc thứ hai sau khi H2 bay đi thì khối lượng cũng phải tăng 14 gam, nghĩa là: (1điểm) 2Al + 3H2SO4 Al2(SO4)3 + 3H2 a/27 3/2 . a/27 a – a.3.2/27.2 = 14 Giải được a = 15,75g 2.(2 điểm) Áp dụng phương pháp đường chéo 160 + 5.18 = 250 (g) (0,5điểm) %CuSO4 = (0,5điểm) Xem tinh thể CuSO4.H2O là dung dịch CuSO4 nồng độ 64% (1điểm) m (g) 64 10 14 => => m = 40 200(g) 4 50 Vậy khối lượng tinh thể CuSO4.5H2O cần lấy là 40g Câu 4: (4điểm) (3điểm) Xđ cơng thức oxit sắt FexOy cĩ a mol Số mol Ba(OH) 2 = 1.0,1 = 0,1 (mol) Số mol BaCO3 = 9,85/197 = 0,05 (mol) FexOy + y CO x Fe + y CO2 (1) a ax ay CO2 + Ba(OH)2 BaCO3 ↓ + H2O .(2) 0,05 0,05 0,05 2CO2 + Ba(OH)2 Ba(HCO3)2 (3) 0,1 0,05 Fe + 2 HCl FeCl2 + H2 ax ax + Nếu tạo muối trung hồ thì: ay = 0,05 và ax = 12,7/127 = 0,1 x/y = 2 (vơ lí) + Nếu tạo muối trung hồ và muối axit : Từ (2), (3) ta cĩ nCO2 = 0,15 mol Ta cĩ hệ ay = 0,15 và ax = 0,1 x = 2 và y = 3 Oxit sắt Fe2O3 b.Tính m (1điểm) Fe2O3 + 3 CO 2Fe + 3 CO2 (5) 0,05 0,15 m = m Fe2O3 = 0,05. 160 = 8 gam Câu 5: (4 điểm) Khi cho hỗn hợp A vào nước dư rồi khuấy kĩ cĩ PƯ sau: K2O + H2O 2 KOH (1) (0,25điểm) Sau đĩ KOH sẽ hồ tan Al2O3, cĩ thể hồ tan hết hoặc một phần nhưng CuO khơng bị hồ tan Al2O3 + 2KOH 2 KAlO2 + H2O (2) (0,5điểm) Sau TN2 thấy khối lượng chất khơng tan tăng lên so với lần thứ nhất là 21 – 15 = 6g. Chứng tỏ Al2O3 cịn dư và KOH đã hết. Khi tăng 75% - 50% = 25% lượng Al2O3 ở TN3 thì lượng chất khơng tan tăng 25 – 21 = 4 g. Vậy lượng Al2O3 ban đầu là: 4.100/25 = 16 (g) (1điểm) Trở lại TN2, khi tăng 50% lẽ ra khối lượng Al2O3 phải tăng 16.50/100 = 8g nhưng thực tế chỉ tăng 6g. Vậy sau TN1 lượng KOH cịn dư để hồ tan hết 2g Al2O3 nữa. Suy ra lượng Al2O3 bị hồ tan tổng cộng 16 + 2 = 18g (1điểm) Do vậy chất khơng tan ở TN1 là CuO = 15g (0,5điểm) Theo PT (1) và (2) n K2O = n Al2O3 = 18/102 (0,5điểm) m K2O = 18/102 x 94 = 16,59g (0,25điểm) Bài 6 : 4 điểm nCa(OH)2 = 0,2 mol ; n CaCO3 = 0,1 mol , n CxHy = 0,1 mol 0,75 điểm CxHy + ( x + y/4) O2 x CO2 + y/2 H2O 0,5 điểm 1mol x mol y/2 (mol) 0,1 0,1x 0,05y (mol) * TH1: Sản phẩm chỉ cĩ 1 muối CO2 + Ca(OH)2 CaCO3 ↓ + H2O . (1điểm) 0,1 0,1 0,1 n CO2 = 0,1 (mol) x = 1 Cĩ m tăng = m CO2 + m H2O = 18,6 (g) m H2O = 18,6 – 44.0,1 = 14,2 (g) n H2O = 14,2/18 = 71/90 (mol) 0,05y = 71/90 y = 142/9 (loại) * TH2: Sản phẩm gồm 2 muối CO2 + Ca(OH)2 CaCO3 ↓ + H2O . 0,1 0,1 0,1 2CO2 + Ca(OH)2 Ca(HCO3)2 (1,25điểm) 0,2 0,1 Tổng số mol CO2 = 0,1 + 0,2 = 0,3 mol Theo bài : 0,1x = 0,3 .Suy ra x = 3 Cĩ m tăng = m CO2 + m H2O = 18,6 (g) m H2O = 18,6 – 44.0,3 = 5,4 (g) n H2O = 5,4/18 = 0,3 (mol) 0,05y = 0,3 y = 6 Vậy CTPT của A là C3H6 b. Viết được CTCT : (0,5 điểm)
Tài liệu đính kèm:
 ĐỀ MH.doc
ĐỀ MH.doc





