Tóm tắt lý thuyết Hóa học – Ôn thi THPT quốc gia
Bạn đang xem tài liệu "Tóm tắt lý thuyết Hóa học – Ôn thi THPT quốc gia", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
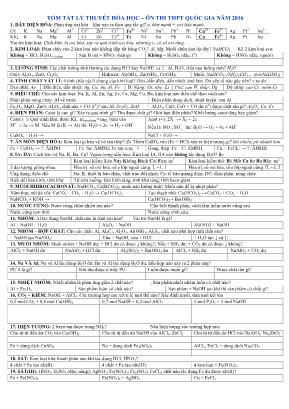
TÓM TẮT LÝ THUYẾT HÓA HỌC – ÔN THI THPT QUỐC GIA NĂM 2016 1. DÃY ĐIỆN HÓA: Phản ứng oxi hóa – khử xảy ra theo quy tắc gì? α, khử mạnh + oxi hóa mạnh. O↑ K+ Na+ Mg2+ Al3+ Cr2+ Zn2+ Cr3+ Fe2+ Ni 2+ Sn 2+ Pb 2+ H + Cu 2+ Fe 3+ Ag + Pt 2+ Au 3+ Kh↓ K Na Mg Al Cr Zn Cr2+ Fe Ni Sn Pb H2 Cu Fe 2+ Ag Pt Au Vai trò kim loại: Chất khử; bị oxi hóa, xảy ra quá trình oxi hóa, nhường e, có số oxi tăng. 2. KIM LOẠI: Đám cháy của 2 kim loại nào không dập tắt bằng CO2? Al, Mg; Muối chữa đau dạ dày? NaHCO3 Kể 2 kim loại sau: Không + HCl, H2SO4 (loãng) Sau H mà + HNO3 (loãng) Không + H2SO4 (đặc, t o ) Không + HNO3 (đặc, nguội) 3. LƯỠNG TÍNH: Các chất lưỡng tính thường tác dụng HCl hay NaOH? cả 2 Al, H2O, chất nào lưỡng tính? H2O Oxit: Al2O3, ZnO, Cr2O3 Hiđroxit: Al(OH)3, Zn(OH)2, Cr(OH)3 Muối: NaHCO3, (NH4)2CO3,... (trừ NaHSO4) 4. TÍNH CHẤT VẢT LÍ: 4 tính chất vật lí chung của kim loại? Dẻo, dẫn điện, dẫn nhiệt, ánh kim. Do yếu tố nào gây nên? e tự do Dẻo nhất: Au Dẫn điện, dẫn nhiệt: Ag, Cu, Au, Al, Fe D: Nặng: Os, nhẹ: Li t°nc: cao W, thấp: Hg Độ cứng: cao Cr; mềm Cs 5. ĐIỀU CHẾ: Cho các kim loại: Na, K, Al, Zn, Ag, Fe, Ca, Mg, Cu, Ba, kim loại nào điều chế theo cách sau? Điện phân nóng chảy: Al về trước Điện phân dung dịch, nhiệt luyện: sau Al Fe2O3, MgO, ZnO, Al2O3, chất nào + CO (t o )? sau Al: Fe2O3, ZnO Al2O3, CuO, FeO + CO dư (t o) được chất rắn gì? Al2O3, Cu, Fe 6. ĐIỆN PHÂN: Catot là cực gì? Xảy ra quá trình gì? Thu được chất gì? Giới hạn điện phân? Khối lượng catot tăng hay giảm? Catot (–): Quá trình khử, được KL. mcatot tăng = mKL bám vào M n+ + 2e → M. Nếu M là (K → Al) thì: H2O + 2e → H2 + OH – Anot (+): 2X – → X2 + 2e Nếu là 2 3 4 NO ,SO thì: H2O → O2 + 4e + 4H + CuSO4 + H2O → NaCl + H2O → 7. ĂN MÒN ĐIỆN HÓA: Kim loại gì bảo vệ vỏ tàu thép? Zn Thêm CuSO4 vào (Fe + HCl) xảy ra hiện tượng gì? khí nhiều, pứ nhanh hơn Fe + CuSO4 → ?: ĂMĐH Fe–Sn: ĂMĐH; Fe tan (cực –) Gang, thép: Fe – C: ĂMĐH Cu + FeCl3: → ?: ĂMHH 8. IA; IIA: Cách bảo vệ Na, K, Ba, Ca? Ngâm trong dầu hỏa; Kim loại IA, IIA nào không tác dụng H2O? Be Kim loại kiềm: Lâu Nay Không Rảnh Coi Fim: ns1 Kim loại kiềm thổ: Bé Mất Ca Sợ Ba Rầy: ns2 3 đại lượng giống nhau Hóa trị, số oxi hóa, số e lớp ngoài cùng: I, +1, 1 Hóa trị, số oxi hóa, số e lớp ngoài cùng: II, +2, 2 Ứng dụng, điều chế Na, K: thiết bị báo cháy, chất trao đổi nhiệt; Cs: tế bào quang điện; ĐC: điện phân nóng chảy Biến đổi bán kính, tính khử Từ trên xuống: bán kính tăng, tính khử tăng; tính bazơ giảm 9. MUỐI HIĐROCACBONAT: NaHCO3, Ca(HCO3)2, muối nào lưỡng tính? Muối nào dễ bị nhiệt phân? Xâm thực núi đá vôi: CaCO3 + CO2 + H2O → Ca(HCO3)2 Tạo thạch nhũ: Ca(HCO3)2 → CaCO3 + CO2 + H2O NaHCO3 + KOH → Ca(HCO3)2 + Ba(OH)2 10. NƯỚC CỨNG: Nước cứng chứa nhiều ion nào? Cho biết thành phần, cách làm mềm nước cứng sau Nước cứng tạm thời: Nước cứng vĩnh cửu: 11. NHÔM: Al tác dụng NaOH, chất nào là chất oxi hóa? Vai trò NaOH là gì? Al + NaOH + H2O Al2O3 + NaOH Al(OH)3 + NaOH 12. NHÔM – HỢP CHẤT: Cho các chất: Al, Al4C3, Al2O3, Al(OH)3, Al2S3, chất nào phù hợp tính chất sau? + NaOH tạo NaAlO2: Vừa + NaOH, vừa + HCl: + H2O tạo ↓ và ↑: 13. MUỐI NHÔM: Muối nhôm + NaOH dư; + HCl dư có được ↓ không?; Nếu + NH3 dư; + CO2 dư có được ↓ không? AlCl3 + NaOH dư NaAlO2 + HCl dư Al2(SO4)3 + Ba(OH)2 dư AlCl3 + NH3 dư NaAlO2 + CO2 dư 14. Na VÀ Al: Na và Al lác dưng H2O dư; Ba và Al tác dụng H2O dư, hỗn hợp nào xảy ra 2 phản ung? PƯ 2 là gì? Khí thu được ở mấy PƯ: Luôn được muối gì? Được chất rắn gì? 15. NHIỆT NHÔM: Nhiệt nhôm là phản ứng giữa 2 chất nào? ; Sản phẩm nhiệt nhôm luôn có chất nào? Al + Fe2O3 Sản phẩm luôn có chất nào? Sản phẩm + NaOH tạo khí thì sản phẩm có chất gì? 16. CO2 + KIỀM; NaOH + AlCl3: Các trường hợp sau xét tỉ lệ mol thế nào? Xác định muối, tính mol kết tủa 0,5 mol CO2 + 0,4 mol Ca(OH)2 0,7 mol NaOH + 0,2 mol AlCl3 1 mol P2O5 + 3 mol NaOH 17. HIỆN TƯỢNG: 2 bazơ tan được trong NH3? Nêu hiện tượng các trường hợp sau: Cho từ từ đến dư CO2 vào Ca(OH)2 Cho từ từ đến dư NaOH vào AlCl3, ZnCl2 Cho từ từ đến dư HCl vào NaAlO2, Na2ZnO2 Fe + dung dịch CuSO4 Na + dung dịch Fe2(SO4)3 AlCl3, FeCl3 + dung dịch Na2CO3 18. SẮT: Kim loại khử thành phần nào khi tác dụng HCl, HNO3? 4 chất + Fe tạo sắt(II): 4 chất + Fe tạo sắt(III): 4 kim loại + Fe(NO3)3: 19. SẮT(III): HNO3; H2SO4 (đặc, nóng); AgNO3; Fe(NO3)3; Fe2(SO4), FeCl3, chất nào tác dụng Fe dư được sắt(II)? Fe + Fe(NO3)3 Fe(NO3)2 + AgNO3 Cu + FeCl3 20. SẮT – HỢP CHẤT: Sắt có tính chất vật lí đặc biệt gì? FeO, Fe3O4 luôn nhường mấy electron? Fe Fe2O3 FeO Fe3O4 Fe(OH)2 Fe(OH)3 Fe(NO3)2 FeS FeCO3 FeCl2 + HNO3 tạo NO, NO2 + HNO3 tạo PƯ trao đổi + HCl tạo khí 21. CROM: Cr2O3, Cr có tác dụng NaOH (loãng) không? ; Chất nào tác dụng Cr tạo crom(III)? CrO Cr2O3 CrO3 22. MUỐI CROM: Thêm bazơ, màu da cam hay màu vàng đậm hơn? Cho biết công thức, màu, tính oxi hóa: Kali đicromat: Kali cromat: Kali pemanganat: 23. KIM LOẠI + MUỐI: Fe và Al tác dụng dung dịch AgNO3. Hãy trả lời các câu hỏi sau Phản ứng đầu tiên Luôn được kim loại Luôn được muối Nếu được 2 kim loại thì đó là Nếu được 2 muối thì đó là 24. KIM LOẠI + MUỐI: Cho các kim loại: Al, Na, Ag, Cu, Fe, Zn, Mg, Ca, kim loại nào tác dụng với các dung dịch sau? Dung dịch CuCl2 Dung dịch NaOH Dung dịch FeCl3 Dung dịch FeCl2 Dung dịch HCl, H2SO4 (loãng) 25. PHẢN ỨNG QUAN TRỌNG: Phản ứng nào là phản ứng oxi hóa – khử? Cho biết số lượng muối thu được Fe3O4 + HCl, H2SO4 (loãng) NaOH + Cl2 Cl2 + Ca(OH)2 NO2 + NaOH NaHCO3 + KOH 26. MÔI TRƯỜNG: Cách bảo quản thực pnẩm an toàn:.......................... Xử lí Hg: Xử lí khí thải: SO2, HF Bệnh phổi Mưa axit Hiệu ứng nhà kính Năng lượng sạch Thủng tầng ozon Xử lí kim loại Phát hiện H2S Gây nghiện 27. NGUYÊN TỬ: Kim loại, khí hiếm có mấy lớp e lớp ngoài cùng? Cấu hình e, loại nguyên tố Chu kì, nhóm Số e lớp ngoài cùng, hóa trị Cách sản xuất Nặng hay nhẹ Na K Al Fe 28. HALOGEN: Halogen thuộc nhóm mấy?.......... Số e lớp ngoài cùng? Cho biết màu, trạng thái, số oxi hóa trong hợp chất? F Cl Br I Tính oxi hóa, khử, tính axit + Fe tạo muối 29. TỐC ĐỘ: Tốc độ phản ứng tính theo công thức nào? Xét các yếu tố ảnh hưởng: Nhiệt độ Nồng độ Áp suất Xúc tác Diện tích tiếp xúc Tốc độ phản ứng Cân bằng hoá học 30. LIÊN KẾT: 2 phi kim thường tạo liên kết gì? ; Kim loại IA với phi kim VIIA thường tạo liên kết gì? O3, O2, H2, Cl2, N2 HCl, H2O, NH3, C2H6, C2H4 KBr, NaCl 31. NHIÊT PHÂN: Fe(NO3)2, Fe(NO3)3, Fe(OH)3, chất nào nhiệt phân tạo Fe2O3? ; Cho biết sản phẩm nhiệt phân: NaNO3, KNO3 Mg(NO3)2 đến Cu(NO3)2 AgNO3, Hg(NO3)2 NH4NO3, NH4NO2 NH4Cl, (NH4)2CO3 32. PHÂN BÓN: Phân đạm, phân lân, kali cung cấp nguyên tố? Độ dinh dưỡng phân đạm, phân lân, kali: Đạm urê: Đạm amoni: Nitrophotka: Amophot: Supephotphat đơn: 33. SỐ OXI HÓA: SO2, FeO, NO2, Cl2, N2, C, CO, FeCl2, Fe(NO3)2, FeSO4, mấy chất vừa khử, vừa oxi hóa? Số oxi hóa các chất sau N: S: C: Halogen: Fe: Cr 34. KHÍ: Màu, tính oxi hóa – khử, tác dụng nước vôi trong, ứng dụng của các khí sau: NO2 NO N2, N2O O2 O3 CO CO2 SO2 SO3 Cl2 35. MÀU: 2 kim loại bền trong không khí và nước? Tại sao bền? Cho biết tính tan, màu của các chất sau: Al(OH)3 Fe(OH)2 Fe(OH)3 Cu(OH)2 CuS, PbS KMnO4 K2Cr2O7 K2CrO4 36. THU KHÍ: Dời chỗ nước dùng thu khí có đặc điểm gì? . Khí thu bằng cách dời chỗ nước: Khí thu bằng cách dời chỗ không khí: 37. ĐIỀU KIỆN THƯỜNG: Ba, Na2O, Na, CaO, NaH, mấy chất + H2O tạo khí? Phản ứng xảy ra ở điều kiện thường ? Li + N2 Hg + S F2 + H2O/H2 HF + SiO2 H2S + SO2 Al2S3, Al4C3 + H2O CaC2 + H2O 38. ĐƠN CHẤT: NH3 tác dụng O2 (t o) luôn được khí gì? Nếu có thêm Pt thì tạo khí gì? Phản ứng tạo đơn chất? F2 + H2O O3 + KI/Ag NH3 + Cl2/O2/CuO/CrO3 Si + NaOH FeCl3 + KI FeS2 + HCl Na2S2O3 + HCl KMnO4 + HCl đặc 39. QUẶNG: Thành phần chính gang, thép là gì? Cho biết công thức, ứng các quặng sau: Boxit Phèn chua Criolit Thạch cao sống Thạch cao nung Đôlômit Hematit Manhetit Xiđerit Pirit 40. CÔNG THỨC CHUNG: Công thức và điều kiện số C các chất sau: Ankan Anken Ankin, ankađien Ancol, ete: no, hở, đơn Anđehit: no, hở, đơn Este, axit: no, hở, đơn 41. CHẤT – ỨNG DỤNG : Công thức, ứng dụng và cho biết chất nào tác dụng dung dịch brom? Metan Etilen Axetilen Ancol etylic Fomanđehit Axit fomic Axit axetic 42. HIỆN TƯỢNG: Đun nóng lòng trắng trứng xảy ra hiện tượng gì? Cho biết hiện tượng của các trường hợp dưới đây: Tinh bột + I2 Lòng trắng trứng + Cu(OH)2 Glixerol + Cu(OH)2 lắc nhẹ Glucozơ + Cu(OH)2 (t o ) FeCl3 + CH3NH2 + H2O 43. Na–NaOH: Ancol etylic, axit axetic, etyl axetat, phenol, glyxin, metyl acrylat. Chất nào có các tính chất sau? Tác dụng Na, không tác dụng NaOH Vừa tác dụng Na, NaOH Tác dụng NaOH, không tác dụng Na Tác dụng NaOH tạo ancol 44. OXI HÓA ANCOL: Ancol bậc I, bậc II oxi hóa tạo sản phẩm hữu cơ nào? CH3OH + CuO C2H5OH + CuO C2H4(OH)2 + CuO CH3CH2CH2OH + CuO (CH3)2CHOH + CuO 45. ETE: Viết phản ứng ancol tạo ete: 2 ancol được mấy ete? Quan hệ mol: Bảo toàn khối lượng: 46. ANĐEHIT: Viết phương trình tráng bạc: CH3–CHO Axetanđehit: CH3CHO Tráng bạc Dung dịch brom Cu(OH)2, t o Dung dịch KMnO4 H2 (Ni, t o ) Hiện tượng Vai trò anđehit 47. AXIT: Axit axetic tác dụng với kim loại nào? Trường hợp nào có phản ứng, nêu hiện tượng? Đá vôi (CaCO3) Tráng bạc Quỳ tím Na Cu Cu(OH)2 Xút (NaOH) Nước brom Axit axetic: CH3COOH Axit fomic: HCOOH 48. ESTE: Cho biết công thức este; số NaOH phản ứng và sản phẩm tạo thành của các este dưới đây: Etyl axetat: Metyl acrylat: Vinyl axetat: Phenyl axetat: 49. CHẤT BÉO: Công thức chung của chất béo là gì? Xà phòng hoá chất béo luôn được chất nào? Axit stearic Axit oleic Tristearin Triolein Công thức, M Sản phẩm + NaOH Tác dụng H2, Br2 50. AMIN – PHENOL: Tính chất chung của amin là gì? Xử lí mùi tanh của cá dùng chất gì? Metylamin Anilin Phenol + NaOH, + HCl tạo sản phẩm? Quỳ tím Dung dịch brom 51. AMINO AXIT: Amino axit đơn, đa hay tạp chức? Tính chất hoá học chung của amino axit là gì? Glyxin: Alanin: Valin: Axit glutamic: Lysin: Quỳ tím + NaOH; + HCl 52. PEPTIT: Peptit luôn có phản ứng nào? Phản ứng này tạo chất gì? Đipeptit (Ala–Gly) Tripeptit (Ala–Ala–Gly) Pentapeptit (Ala–Val–Val–Gly–Gly) Số gốc; số N Số liên kết peptit, M +Cu(OH)2 (biure) Thuỷ phân 53. TRÙNG HỢP – TRÙNG NGƯNG: Cho biết: loại phản ứng, tên và ứng dụng của polime thu được CH2=CH2 CF2=CF2 CH2=CH–Cl CH2=CH–CN C6H5–CH=CH2 CH2=C(CH3)–COOCH3 H2N–[CH2]5–COOH 54. ĐỒNG TRÙNG NGƯNG: Cho biết: loại phản ứng, tên monome tạo các polime sau: Nilon–6,6 Poli(etylen–terephtalat) Phenol–fomanđehit Cao su buna–S/N 55. TƠ: Tơ khác chất dẻo ở điểm nào? Cho ví dụ các loại tơ sau, tơ nào là tơ hoá học? Tơ thiên nhiên: Tơ nhân tạo (bán tổng hợp): Tơ tổng hợp: 56. CACBOHIĐRAT – PHÂN LOẠI Glucozơ: Fructozơ: Mantozơ: Saccarozơ: Tinh bột: Xenlulozơ: Tên, tính tan, màu Cấu tạo, mạch C Thuỷ phân Tráng bạc Cu(OH)2, lắc nhẹ Cu(OH)2, đun nóng Phản ứng riêng 57. CẤU TẠO GLUCOZƠ: Glucozơ có tính chất của chất nào? Các phản ứng sau xác định cấu tạo gì của glucozơ? + Cu(OH)2, lắc nhẹ Tráng bạc hoặc Br2 + Cu(OH)2, đun nóng Khử glucozơ tạo hexan 58. CACBOHIĐRAT – PHẢN ỨNG: Cho biết sản phẩm của các phản ứng sau: Glucozơ + men rượu Xenlulozơ + HNO3 Tinh bột → X + Y Glucozơ + H2 59. KHỐI LƯỢNG THAY ĐỔI: Cho CO2 vào nước vôi trong dư được muối gì? Quan hệ mol: Khối lượng bình H2SO4 (đặc) tăng Khối lượng bình bazơ tăng Khối lượng dung dịch giảm 61. POLIME – PHÂN TỬ KHỐI: 2 polime nào có cấu trúc mang không gian? Phân tử khối các polime sau: Sợi bông, gai, đay Nilon–6; capron Nilon–6,6 62. SỐ SẢN PHẨM: Cho biết số lượng sản phẩm và tên sản phẩm chính mỗi trường hợp sau: Propen + HCl Propen + H2O Propen + Br2 Propan + Cl2 But–2–en + HCl But–1–en + H2O 63. PHẢN ỨNG QUAN TRỌNG: Xác định công thức của X, Y, Z, T, Q trong các phản ứng sau: CH4→ X↑ C2H2 + H2O→ Y CaC2 + H2O → Z↑ Al4C3 + H2O → T↑ CH3COONa + NaOH (CaO, t o ) → Q↑ 64. TRÁNG BẠC: Ứng dụng của glucozơ trong công nghiệp, y học? HCOOCH3 HCHO CH3CHO Etyl fomat Glucozơ Fructozơ Mantozơ HCOOH (CHO)2 Số Ag tạo 65. AgNO3/NH3: Chất hữu cơ có nhóm chức gì tác dụng với AgNO3/NH3? Tác dụng AgNO3/NH3 Anđehit fomic Anđehit axetic Axetilen Propin CH3OH CH3COOH Hiện tượng, sản phẩm 66. SO SÁNH H2O, CO2: So sánh mol H2O và CO2 khi đốt cháy các chất sau: Ankan Anken Ankin, ankađien Ancol no, hở Anđehit, axit, este: đơn, no, hở Amin no, hở 67. SO SÁNH BAZƠ: Chất nào có liên kết hiđro? So sánh nhiệt độ sôi; tính bazơ; tính axit Nhiệt độ sôi: Tính bazơ: Tính axit: 68. ĐỒNG PHÂN: Số lượng đồng phân cấu tạo, mạch hở của các chất sau: C4H10 C4H8 C4H6 C3H8O C4H8O C3H6O2 C4H8O2 C3H9N 69. ĐỒNG PHÂN: Số đồng phân của các trường hợp sau: C7H8O, C7H9N có mấy đồng phân + Br2? 2 axit béo tạo được mấy chất béo? 2 amino axit tạo được mấy đipeptit? 70. TÊN PHẢN ỨNG: Tên gọi và chiều của các phản ứng sau: Este + NaOH Axit cacboxylic + ancol Eilen tạo PE Tạo nilon–6,6 Este + H2O (H + ) Cây xanh tạo tinh bột 71. PHẢN ỨNG ĐẶC TRƯNG: Cho biết phản ứng đặc trưng của các chất sau: Ankan: Anken: Ankin: Toluen, phenol, anilin: 72. THÀNH PHẦN: Hiđrocacbon ở thể khí có mấy C? Các chất sau chứa nguyên tố gì? Ankan, anken, ankin, benzen, toluen, stiren Ancol, anđehit, axit, este, cacbohiđrat Amin, aminoaxit, peptit, protein TÓM TẮT LÝ THUYẾT HÓA HỌC – ÔN THI THPT QUỐC GIA NĂM 2016 1. DÃY ĐIỆN HÓA: Phản ứng oxi hóa – khử xảy ra theo quy tắc gì? α, khử mạnh + oxi hóa mạnh. O↑ K+ Na+ Mg2+ Al3+ Cr2+ Zn2+ Cr3+ Fe2+ Ni 2+ Sn 2+ Pb 2+ H + Cu 2+ Fe 3+ Ag + Pt 2+ Au 3+ Kh↓ K Na Mg Al Cr Zn Cr2+ Fe Ni Sn Pb H2 Cu Fe 2+ Ag Pt Au Vai trò kim loại: Chất khử; bị oxi hóa, xảy ra quá trình oxi hóa, nhường e, có số oxi tăng. 2. KIM LOẠI: Đám cháy của 2 kim loại nào không dập tắt bằng CO2? Al, Mg; Muối chữa đau dạ dày? NaHCO3 Kể 2 kim loại sau: Không + HCl, H2SO4 (loãng) Sau H mà + HNO3 (loãng) Không + H2SO4 (đặc, t o ) Không + HNO3 (đặc, nguội) 3. LƯỠNG TÍNH: Các chất lưỡng tính thường tác dụng HCl hay NaOH? cả 2 Al, H2O, chất nào lưỡng tính? H2O Oxit: Al2O3, ZnO, Cr2O3 Hiđroxit: Al(OH)3, Zn(OH)2, Cr(OH)3 Muối: NaHCO3, (NH4)2CO3,... (trừ NaHSO4) 4. TÍNH CHẤT VẢT LÍ: 4 tính chất vật lí chung của kim loại? Dẻo, dẫn điện, dẫn nhiệt, ánh kim. Do yếu tố nào gây nên? e tự do Dẻo nhất: Au Dẫn điện, dẫn nhiệt: Ag, Cu, Au, Al, Fe D: Nặng: Os, nhẹ: Li t°nc: cao W, thấp: Hg Độ cứng: cao Cr; mềm Cs 5. ĐIỀU CHẾ: Cho các kim loại: Na, K, Al, Zn, Ag, Fe, Ca, Mg, Cu, Ba, kim loại nào điều chế theo cách sau? Điện phân nóng chảy: Al về trước Điện phân dung dịch, nhiệt luyện: sau Al Fe2O3, MgO, ZnO, Al2O3, chất nào + CO (t o )? sau Al: Fe2O3, ZnO Al2O3, CuO, FeO + CO dư (t o) được chất rắn gì? Al2O3, Cu, Fe 6. ĐIỆN PHÂN: Catot là cực gì? Xảy ra quá trình gì? Thu được chất gì? Giới hạn điện phân? Khối lượng catot tăng hay giảm? Catot (–): Quá trình khử, được KL. mcatot tăng = mKL bám vào M n+ + 2e → M. Nếu M là (K → Al) thì: H2O + 2e → H2 + OH – Anot (+): 2X – → X2 + 2e (X là halogen) Nếu là 2 3 4 NO ,SO thì: H2O → O2 + 4e + 4H + CuSO4 + H2O → NaCl + H2O → 7. ĂN MÒN ĐIỆN HÓA: Kim loại gì bảo vệ vỏ tàu thép? Zn Thêm CuSO4 vào (Fe + HCl) xảy ra hiện tượng gì? khí nhiều, pứ nhanh hơn Fe + CuSO4 → ?: ĂMĐH Fe–Sn: ĂMĐH; Fe tan (cực –) Gang, thép: Fe – C: ĂMĐH Cu + FeCl3: → ?: ĂMHH 8. IA; IIA: Cách bảo vệ Na, K, Ba, Ca? Ngâm trong dầu hỏa; Kim loại IA, IIA nào không tác dụng H2O? Be Kim loại kiềm: Lâu Nay Không Rảnh Coi Fim: ns1 Kim loại kiềm thổ: Bé Mất Ca Sợ Ba Rầy: ns2 3 đại lượng giống nhau Hóa trị, số oxi hóa, số e lớp ngoài cùng: I, +1, 1 Hóa trị, số oxi hóa, số e lớp ngoài cùng: II, +2, 2 Ứng dụng, điều chế Na, K: thiết bị báo cháy, chất trao đổi nhiệt; Cs: tế bào quang điện; ĐC: điện phân nóng chảy Biến đổi bán kính, tính khử Từ trên xuống: bán kính tăng, tính khử tăng; tính bazơ giảm 9. MUỐI HIĐROCACBONAT: NaHCO3, Ca(HCO3)2, muối nào lưỡng tính? Muối nào dễ bị nhiệt phân? Xâm thực núi đá vôi: CaCO3 + CO2 + H2O → Ca(HCO3)2 Tạo thạch nhũ: Ca(HCO3)2 → CaCO3 + CO2 + H2O 2NaHCO3 + 2KOH → Na2CO3 + K2CO3 + 2H2O Ca(HCO3)2 + Ba(OH)2 → CaCO3 + BaCO3 + 2H2O 10. NƯỚC CỨNG: Nước cứng chứa nhiều ion nào? Ca2+, Mg2+ Cho biết thành phần, cách làm mềm nước cứng sau Nước cứng tạm thời: có 3 HCO ① t°, ②Ca(OH)2, ③ Na2CO3, Na3PO4 Nước cứng vĩnh cửu: có Cl–, 2 4 SO ③ Na2CO3, Na3PO4 11. NHÔM: Al tác dụng NaOH, chất nào là chất oxi hóa? H+ (H2O) Vai trò NaOH là gì? Hòa tan Al2O3, Al(OH)3 Al + NaOH + H2O → NaAlO2 + 1,5H2 Al2O3 + 2NaOH → 2NaAlO2 + H2O Al(OH)3 + NaOH → NaAlO2 + 2H2O 12. NHÔM – HỢP CHẤT: Cho các chất: Al, Al4C3, Al2O3, Al(OH)3, Al2S3, chất nào phù hợp tính chất sau? + NaOH tạo NaAlO2: tất cả Vừa + NaOH, vừa + HCl: tất cả + H2O tạo ↓ và ↑: Al4C3, Al2S3 13. MUỐI NHÔM: Muối nhôm + NaOH dư; + HCl dư có được ↓ không?; Nếu + NH3 dư; + CO2 dư có được ↓ không? AlCl3 + NaOH dư NaAlO2 + HCl dư Al2(SO4)3 + Ba(OH)2 dư AlCl3 + NH3 dư NaAlO2 + CO2 dư ↓trắng, tăng dần sau đó tan hết ↓trắng, ↓ tan một phần ↓trắng, ↓ không tan ↓trắng, ↓ không tan 14. Na VÀ Al: Na và Al tác dụng H2O dư; Ba và Al tác dụng H2O dư, hỗn hợp nào xảy ra 2 phản ung? PƯ 2 là gì? Khí thu được ở mấy PƯ: Luôn được muối gì? Được chất rắn gì? Al + OH– + H2O → 2AlO + 1,5H2 Cả 2 2AlO Al dư 15. NHIỆT NHÔM: Nhiệt nhôm là phản ứng giữa 2 chất nào? Al + oxit KL ; Sản phẩm nhiệt nhôm luôn có chất nào? Al2O3, 2Al + Fe2O3 → Al2O3 + 2Fe Sản phẩm luôn có chất nào? Al2O3 + Fe Sản phẩm + NaOH tạo khí thì sản phẩm có chất gì? Al dư 16. CO2 + KIỀM; NaOH + AlCl3: Các trường hợp sau xét tỉ lệ mol thế nào? Xác định muối, tính mol kết tủa 0,5 mol CO2 + 0,4 mol Ca(OH)2 0,7 mol NaOH + 0,2 mol; AlCl3 1 mol P2O5 + 3 mol NaOH 2 OH CO = 1,6 2 2 3 COCO OH n n n ↓ = 3 OH 3,5 Al n↓ = 3 Al OH 4n n 3 4 OH 1,5 H PO 2 3 2 4 H PO HPO 17. HIỆN TƯỢNG: 2 bazơ tan nào tan được trong NH3? Cu(OH)2, Zn(OH)2 Nêu hiện tượng các trường hợp sau: Cho từ từ đến dư CO2 vào Ca(OH)2 Cho từ từ đến dư NaOH vào AlCl3, ZnCl2 Cho từ từ đến dư HCl vào NaAlO2, Na2ZnO2 Xuất hiện ↓, ↓ tăng dần đến cực đại, sau đó ↓ tan dần đến hết Fe + dung dịch CuSO4 Na + dung dịch Fe2(SO4)3 → (2 pứ) AlCl3, FeCl3 + dung dịch Na2CO3 Cu đỏ bám vào Fe, dd xanh nhạt dần có khí ↑ (H2), có ↓ nâu đỏ có khí ↑ (CO2), có ↓ Al(OH)3, Fe(OH)3 18. SẮT: Kim loại khử thành phần nào khi tác dụng HCl, HNO3? HCl: khử H + → H2; HNO3: khử N +5 → NO, NO2,... 4 chất + Fe tạo sắt(II): S, I2, HCl, H2SO4 l 4 chất + Fe tạo sắt(III): Cl2, Br2, HNO3, H2SO4 đ,n 4 kim loại + Fe(NO3)3: Cu, Fe, Al, Mg 19. SẮT(III): HNO3; H2SO4 (đặc, nóng); AgNO3; Fe(NO3)3; Fe2(SO4), FeCl3, chất nào tác dụng Fe dư được sắt(II)? Fe + 2Fe(NO3)3 → 3Fe(NO3)2 Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag Cu + 2FeCl3 → CuCl2 + 2FeCl2 20. SẮT – HỢP CHẤT: Sắt có tính chất vật lí đặc biệt gì? Nhiễm từ FeO, Fe3O4 luôn nhường mấy electron? 1e Fe Fe2O3 FeO Fe3O4 Fe(OH)2 Fe(OH)3 Fe(NO3)2 FeS FeCO3 FeCl2 + HNO3 tạo NO, NO2 + HNO3 tạo PƯ trao đổi + HCl tạo khí H2 ↑ NO↑ H2S ↑ CO2 ↑ 21. CROM: Cr2O3, Cr có tác dụng NaOH (loãng) không? đều không ; Chất nào tác dụng Cr tạo crom(III)? Cl2, O2, S, HNO3 CrO: oxit bazơ Cr2O3 : oxit lưỡng tính CrO3: oxit axit (có 2 axit); tự bốc cháy với P, S, NH3, C2H5OH 22. MUỐI CROM: Thêm bazơ, màu da cam hay màu vàng đậm hơn? bazơ → vàng Cho biết công thức, màu, tính oxi hóa: Kali đicromat: K2Cr2O7, da cam Kali cromat: K2CrO4 (vàng) Kali pemanganat: KMnO4, tím 23. KIM LOẠI + MUỐI: Fe và Al tác dụng dung dịch AgNO3. Hãy trả lời các câu hỏi sau Phản ứng đầu tiên Luôn được kim loại Luôn được muối Nếu được 2 kim loại thì đó là Nếu được 2 muối thì đó là Al + Ag + → Ag Al3+ Ag, Fe Al3+, Fe2+ 24. KIM LOẠI + MUỐI: Cho các kim loại: Al, Na, Ag, Cu, Fe, Zn, Mg, Ca. Kim loại nào tác dụng với các dung dịch sau? Dung dịch CuCl2 Dung dịch NaOH Dung dịch FeCl3 Dung dịch FeCl2 Dung dịch HCl, H2SO4 (loãng) Al, Na, Fe, Zn, Mg, Ca Al, Na, Zn, Ca Al, Na, Cu, Fe, Zn, Mg, Ca Al, Na, Zn, Mg, Ca, Al, Na, Fe, Zn, Mg, Ca 25. PHẢN ỨNG QUAN TRỌNG: Phản ứng nào là phản ứng oxi hóa – khử? Cho biết số lượng muối thu được Fe3O4 + HCl, H2SO4 (loãng) NaOH + Cl2 Cl2 + Ca(OH)2 NO2 + NaOH NaHCO3 + KOH Fe 2+ , Fe 3+: pư trao đổi NaClO + NaCl: oxh-kh CaOCl2 (clorua vôi): oxh-kh NaNO3, NaNO2: oxh-kh Na2CO3, K2CO3: TĐ 26. MÔI TRƯỜNG: Cách bảo quản thực phẩm an toàn: Dùng nước đá, ướp muối ăn. Xử lí Hg: S. Xử lí khí thải: SO2, HF: Ca(OH)2 Bệnh phổi Mưa axit Hiệu ứng nhà kính Năng lượng sạch Thủng tầng ozon Xử lí ion KL nặng Phát hiện H2S Gây nghiện nicotin NO2, SO2 CO2, O3, CH4 Gió, thủy triều, điện, (hạt nhân) CFC, hlogen Ca(OH)2 Cu 2+ , Pb 2+ Heroin, morphin 27. NGUYÊN TỬ: Kim loại, khí hiếm có mấy lớp e lớp ngoài cùng? Cấu hình e, loại nguyên tố Chu kì, nhóm Số e lớp ngoài cùng, hóa trị Cách sản xuất Nặng hay nhẹ Na 1s 2 2s 2 2p 6 3s 1 , Z = 11, ngtố s 3, IA 1, I ĐPNC: NaCl, NaOH Nhẹ K 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 , Z = 19, ngtố s 4, IA 1, I ĐPNC: KCl, KOH Nhẹ Al 1s 2 2s 2 2p 6 3s 2 3p 1 , Z = 13, ngtố p 3, IIIA 3, III ĐPNC: Al2O3 Nhẹ Fe [Ar] 3d 6 4s 2 , Z = 26, ngtố d 4, VIIIB 2, II và III ĐP DD muối, khử oxit Nặng 28. HALOGEN: Halogen thuộc nhóm mấy? VIIA Số e lớp ngoài cùng? 7 Cho biết màu, trạng thái, số oxi hóa trong hợp chất? F: khí, xanh nhạt Cl: khí, vàng Br: lỏng, nâu đỏ I: rắn, đen tím Tính oxi hóa, khử, tính axit Oxi hóa : F2 > Cl2 > Br2 > I2, khử I – > Br – > Cl – > F – , tính axit: HI > HBr > HCl > HF + Fe tạo muối Fe3+ Fe3+ Fe3+ Fe2+ 29. TỐC ĐỘ: Tốc độ phản ứng tính theo công thức nào? v = C/t Xét các yếu tố ảnh hưởng: Nhiệt độ Nồng độ Áp suất Xúc tác Diện tích tiếp xúc Tốc độ phản ứng Cân bằng hoá học t°↑ H, thu nhiệt ↑ khác phía, ↓ cùng phía ↑p ↓ mol khí 30. LIÊN KẾT: 2 phi kim thường tạo liên kết gì? cộng hóa trị ; Kim loại IA với phi kim VIIA thường tạo liên kết gì? ion O3, O2, H2, Cl2, N2: cộng HT không cực HCl, H2O, NH3, C2H6, C2H4: cộng HT có cực KBr, NaCl: ion 31. NHIỆT PHÂN: Fe(NO3)2, Fe(NO3)3, Fe(OH)3, chất nào nhiệt phân tạo Fe2O3? cả 3 ; Cho biết sản phẩm nhiệt phân: NaNO3, KNO3 Mg(NO3)2 đến Cu(NO3)2 AgNO3, Hg(NO3)2 NH4NO3, NH4NO2 NH4Cl, (NH4)2CO3 NaNO2, KNO2 + O2 MO + NO2 + O2 Ag, Hg + NO2 + O2 N2O, N2 + H2O NH3 + HCl, H2O + CO2 32. PHÂN BÓN: Phân đạm, phân lân, kali cung cấp nguyên tố? N, P, K. Độ dinh dưỡng phân đạm, phân lân, kali: %N, %P2O5, %K2O Đạm urê: Đạm amoni: NH4NO3 Nitrophotka (hỗn hợp N, P, K) Amophot: (phức hợp) Supephotphat đơn: (NH2)2CO → axit( Bón đất ít chua) (NH4)2HPO4 + HNO3 (NH4)2HPO4 + NH42H2PO4 Ca(H 33. SỐ OXI HÓA: SO2, FeO, NO2, Cl2, N2, C, CO, FeCl2, Fe(NO3)2, FeSO4, mấy chất vừa khử, vừa oxi hóa? tất cả. Số oxi hóa các chất sau N:–3, +1, +2, +3, +4, +5 S:–2, +4, +6 C:–4, +2, +4 Halogen:–1, +1, +3, +5, +7 (F chỉ –1) Fe:+2, +3 Cr: +2, +3, +6 34. KHÍ: Màu, tính oxi hóa – khử, tác dụng nước vôi trong, ứng dụng của các khí sau: NO2 NO N2, N2O O2 O3 CO CO2 SO2 SO3 Cl2 Nâu đỏ, oxh-kh Hóa nâu ngoài kk K màu K màu Xanh nhạt, tẩy trắng K màu, độc K màu, ↓CaCO3 K màu, tẩy trắng, oxh-kh K màu, ↓CaSO4 Vàng, oxh-kh 35. MÀU: 2 kim loại bền trong không khí và nước? Tại sao bền? Al, Cr (có màng oxit) Cho biết tính tan, màu của các chất sau: Al(OH)3 Fe(OH)2 Fe(OH)3 Cu(OH)2 CuS, PbS KMnO4 K2Cr2O7 K2CrO4 ↓ trắng ↓ trắng xanh ↓ nâu đỏ ↓ xanh ↓đen dd tím dd da cam Dd vàng 36. THU KHÍ: Dời chỗ nước dùng thu khí có đặc điểm gì? không tan trong nước Khí thu bằng cách dời chỗ nước: O2, CH4, C2H4, C2H2 Khí thu bằng cách dời chỗ không khí: HCl, NH3, SO2 37. ĐIỀU KIỆN THƯỜNG: Ba, Na2O, Na, CaO, NaH, mấy chất + H2O tạo khí? Ba, Na, NaH Phản ứng xảy ra ở điều kiện thường ? Li + N2 Hg + S F2 + H2O/H2 HF + SiO2 H2S + SO2 Al2S3, Al4C3 + H2O CaC2 + H2O (↓S) 38. ĐƠN CHẤT: NH3 tác dụng O2 (t o) luôn được khí gì? N2 Nếu có thêm Pt thì tạo khí gì? NO Phản ứng tạo đơn chất? F2 + H2O O3 + KI/Ag NH3 + Cl2/O2/CuO/CrO3 Si + NaOH FeCl3 + KI FeS2 + HCl Na2S2O3 + HCl KMnO4 + HCl đặc O2 O2 N2 H2 I2 S↓ (H2S) S↓ Cl2 39. QUẶNG: Thành phần chính gang, thép là gì? Fe –C (Fe là TP chính) Cho biết công thức, ứng dụng các quặng sau: Boxit Phèn chua Criolit Thạch cao sống Thạch cao nung Đôlômit Hematit Manhetit Xiđerit Pirit Al2O3 KAl(SO4)2.12H2O Na3AlF6 CaSO4.2H2O CaSO4.H2O CaCO3.MgCO3 Fe2O3 Fe3O4 FeCO3 FeS SX Al Làm trong nước ↓ t° ĐP Bó bột, đúc tượng SX gang FeS2 40. CÔNG THỨC CHUNG: Công thức và điều kiện số C các chất sau: Ankan Anken Ankin, ankađien Ancol, ete: no, hở, đơn Anđehit: no, hở, đơn Este, axit: no, hở, đơn CnH2n+2 (n1) CnH2n (n2) CnH2n–2 (n2; n3) CnH2n+2O (n1, n2) CnH2nO(n1) CnH2nO2(n2, n1) 41. CHẤT – ỨNG DỤNG : Công thức, ứng dụng và cho biết chất nào tác dụng dung dịch brom? Metan: CH4 Etilen: CH2=CH2 Axetilen: CH≡CH Ancol etylic Fomanđehit Axit fomic Axit axetic Biogaz, thiên nhiên + dd Br2 + dd Br2, chín trái cây C2H5OH HCHO: tấy uế HCOOH CH3COOH 42. HIỆN TƯỢNG: Đun nóng lòng trắng trứng xảy ra hiện tượng gì? đông tụ Cho biết hiện tượng của các trường hợp dưới đây: Tinh bột + I2 Lòng trắng trứng + Cu(OH)2 Glixerol + Cu(OH)2 lắc nhẹ Glucozơ + Cu(OH)2 (t o ) FeCl3 + CH3NH2 + H2O Xanh tím Tím (biure) Dd xanh lam ↓Cu2O đỏ gạch ↓Fe(OH)3 nâu đỏ 43. Na–NaOH: Ancol etylic, axit axetic, etyl axetat, metyl acrylat, phenol, glyxin, . Chất nào có các tính chất sau? Tác dụng Na, không tác dụng NaOH Vừa tác dụng Na, NaOH Tác dụng NaOH, không tác dụng Na Tác dụng NaOH tạo ancol Ancol etylic axit axetic, phenol, glyxin etyl axetat, metyl acrylat etyl axetat, metyl acrylat 44. OXI HÓA ANCOL: Ancol bậc I, bậc II oxi hóa tạo sản phẩm hữu cơ nào? Ancol bậc 1 → anđehit; Ancol bậc 2 → xeton; CH3OH + CuO C2H5OH + CuO C2H4(OH)2 + CuO CH3CH2CH2OH + CuO (CH3)2CHOH + CuO HCHO + Cu + H2O CH3CHO + Cu + H2O (CHO)2 CH3CH2CHO CH3COCH3 45. ETE: Viết phản ứng ancol tạo ete: 2ROH → R2O + H2O 2 ancol được mấy ete? 3 ete (2 đối xứng) Quan hệ mol: nancol pứ = 2nete = 2nH2O Bảo toàn khối lượng: mancol pứ = mete + mH2O 46. ANĐEHIT: Viết phương trình tráng bạc: CH3–CHO + 2AgNO3 + 3NH3 → CH3COONH4 + 2Ag + 2NH4NO3 Axetanđehit: CH3CHO Tráng bạc Dung dịch brom Cu(OH)2, t o Dung dịch KMnO4 H2 (Ni, t o ) Hiện tượng 2Ag Mất màu nâu đỏ ↓Cu2O đỏ gạch Mất màu tím Ancol bậc 1 Vai trò anđehit Khử, bị oxi hóa Khử Khử Khử Oxi hóa 47. AXIT: Axit axetic tác dụng với kim loại nào? trước H Trường hợp nào có phản ứng, nêu hiện tượng? Đá vôi (CaCO3) Tráng bạc Quỳ tím Na Cu Cu(OH)2 Xút (NaOH) Nước brom Axit axetic: CH3COOH ↑CO2 Đỏ ↑H2 ↓tan Axit fomic: HCOOH ↑CO2 2Ag↓ Đỏ ↑H2 ↓tan 48. ESTE: Cho biết công thức este; số NaOH phản ứng và sản phẩm tạo thành của các este dưới đây: Etyl axetat: CH3COOC2H5 Metyl acrylat: CH2=CHCOOCH3 Vinyl axetat: CH3COOCH=CH2 Phenyl axetat: CH3COOC6H5 1NaOH→ muối + ancol 1NaOH→ muối + ancol 1NaOH→ muối + anđehit 2NaOH→ 2muối + H2O 49. CHẤT BÉO: Công thức chung của chất béo là gì? (RCOO)3C3H5 Xà phòng hoá chất béo luôn được chất nào?Glixerol: C3H5(OH)3 Axit stearic: 18C, đơn Axit oleic: 18C, 1 đôi Tristearin Triolein Công thức, M C17H35COOH, 284 C17H33COOH, 284 (C17H35COO)3C3H5; 890 (C17H33COO)3C3H5; Sản phẩm + NaOH Tác dụng H2, Br2 , lỏng + H2 → rắn 50. AMIN – PHENOL: Tính chất chung của amin là gì? bazơ Xử lí mùi tanh của cá dùng chất gì? cá (nhiều amin) + chanh, giấm Metylamin Anilin Phenol + NaOH, + HCl tạo sản phẩm? CH3NH3Cl C6H5NH3Cl C6H5ONa Quỳ tím Xanh Không đổi màu Không đổi màu Dung dịch brom ↓C6H2Br3NH2 (trắng) ↓C6H2Br3OH (trắng) 51. AMINO AXIT: Amino axit đơn, đa hay tạp chức? tạp chức Tính chất hoá học chung của amino axit là gì? lưỡng tính Glyxin:C2H5NO2 (75) Alanin (89) Valin: (117) Axit glutamic: (147) Lysin: (146) Quỳ tím Không đổi màu Không đổi màu Không đổi màu Hồng xanh 52. PEPTIT: Peptit luôn có phản ứng nào? Phản ứng này tạo chất gì? thủy phân → α-aminoaxit Đipeptit (Ala–Gly) Tripeptit (Ala–Ala–Gly) Pentapeptit (Ala–Val–Val–Gly–Gly) Số gốc; số N 2 gốc, 2N 3 gốc, 3N 5 gốc, 5N Số liên kết peptit, M 1, M = 89 + 75 – 18 2, M = 2.89 + 75 – 2.18 4, M = 89 + 2.75 + 117.2 – 4.18 +Cu(OH)2 (biure) không Tạo màu tím xanh Tạo màu tím xanh Thuỷ phân + H2O → Ala+Gly + 3NaOH → 2AlaNa+GlyNa + 1H2O + 5NaOH → muối + 1H2O 53. TRÙNG HỢP – TRÙNG NGƯNG: Cho biết: loại phản ứng, tên và ứng dụng của polime thu được CH2=CH2 CF2=CF2 CH2=CH–Cl CH2=CH–CN C6H5–CH=CH2 CH2=C(CH3)–COOCH3 H2N–[CH2]5–COOH Tr.hợp Tr.hợp Tr.hợp Tr.hợp Tr.hợp Tr.hợp Tr.ngưng PE Teflon PVC Nitron (olon) PS Thủy tinh hữu cơ Nilon-6 Chất dẻo Chống dính Chất dẻo Tơ sợi Kính ô tô, răng giả Tơ sợi 54. ĐỒNG TRÙNG NGƯNG: Cho biết: loại phản ứng, tên monome tạo các polime sau: Nilon–6,6: Poli(etylen–terephtalat) Phenol–fomanđehit Cao su buna–S/N Hexametylen điamin [CH2]6(NH2)2 + a.ađipi [CH2]4(COOH)2 Etylen glicol: C2H4(OH)2 + a.terephtalic C6H4(COOH)2 C6H6OH + HCHO CH2=CH–CH=CH2 + S: stiren; N: CH2=CH–CN 55. TƠ: Tơ khác chất dẻo ở điểm nào? tơ hình sợi dài, mảnh; chất dẻo có tính dẻo Cho ví dụ các loại tơ sau, tơ nào là tơ hoá học? Tơ thiên nhiên (cùng nguồn gốc): Tơ nhân tạo (bán tổng hợp): hóa học Tơ tổng hợp: hóa học bông, len, tơ tằm Tơ visco, tơ axetat Nilon, capron, nitron 56. CACBOHIĐRAT – PHÂN LOẠI Glucozơ: 180 Fructozơ: 180 Mantozơ: 342 Saccarozơ: 342 Tinh bột: 162n Xenlulozơ: 162n Tên, tính tan, màu Đường nho, tan, k màu Đường mật, tan, k màu Đường mạch nha, tan, k màu Đường mía, tan, k màu Gạo, ngô; ktan, trắng Bông, đai, gai; ktan, trắng Cấu tạo, mạch C 5OH, 1CHO α–glu–O–α–glu α–glu–O–β–fru Amilozơ Amilopectin (nhánh) [C6H7O2(OH)3)]n Thuỷ phân Tạo 2 glu T
Tài liệu đính kèm:
 Ly_thuyet_Hoa_hoc_4_diem_THPT_Quoc_gia.pdf
Ly_thuyet_Hoa_hoc_4_diem_THPT_Quoc_gia.pdf





