Tài liệu ôn thi THPT QG môn Hóa
Bạn đang xem tài liệu "Tài liệu ôn thi THPT QG môn Hóa", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
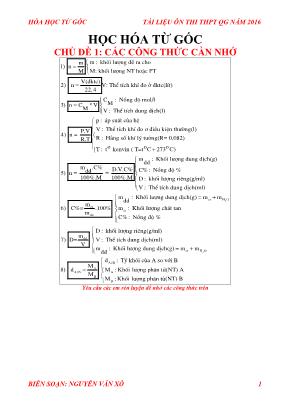
HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 1 HỌC HÓA TỪ GỐC CHỦ ĐỀ 1: CÁC CÔNG THỨC CẦN NHỚ m : khèi lîng ®Ò ra chom 1) n M M: khèi lîng NT hoÆc PT V(dktc) 2) n V: ThÓ tÝch khÝ ®o ë ®ktc(lÝt) 22,4 C : Nång ®é mol/l M3) n C *V M V : ThÓ tÝch dung dÞch(l) p : ¸p suÊt cña hÖ V : ThÓ tÝchP.V 4) n = R.T khÝ ®o ¬ ®iÒu kiÖn thêng(l) R : Hºng sè khÝ lý tëng(R= 0,082) o o oT : t kenvin ( T=t C 273 C) m : Khèi lîng dung dÞch(g) dd m .C% D.V.C% C% : Nång ®é %dd5) n = = 100%.M 100%.M D : khèi lîng riªng(g/ml) V : 2ct H O ct ct dd dd ThÓ tÝch dung dÞch(ml) m : Khèi lîng dung dÞch(g) m m dd m 6) C%= .100% m : Khèi lîng chÊt tan m C% : Nång ®é % D : khèi lîng riªng(g/ml) m 7) D= V : ThÓ tÝch dung dÞch(ml) V m : Khèi l dd 2ct H O A/B A A/B A B B îng dung dÞch(g) m m d : Tû khèi cña A so víi B M 8) d M : Khèi lîng ph©n tö(NT) A M M : Khèi lîng ph©n tö(NT) B Yêu cầu các em rèn luyện để nhớ các công thức trên HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 2 CHỦ ĐỀ 2: HÓA VÔ CƠ ( 5 NGÀY) KIM LOẠI OXIT KL BAZO MUỐI H 2 O PHI KIM 1 2 3 4 5 OXIT PK 6 7 8 9 10 AXIT 11 12 13 14 15 MUỐI 16 17 18 19 20 H 2 O 21 22 23 24 25 THỰC HIỆN NGÀY 1: THỰC HIỆN CÁC MỤC SAU: 1,2,3,4,5 1 KIM LOẠI TÁC DỤNG VỚI PK => KL + O2 Oxit KL => 2M + nO2M2On VD: 2Mg + O2 2MgO => 3Fe + 2O2Fe3O4 => KL + PKMuối =>2 M + nCl2 2MCln ( n là số OXH cao nhất của M) VD: 2Fe + 3Cl2 2FeCl3 =>M + S M2 Sn( n là số OXH thấp nhất) Phải nhớ: Hầu hết KL tác dụng với S ở nhiệt độ cao ( trừ Hg + S ot thêng HgS) 2 OXIT KIM LOẠI TÁC DỤNG VỚI PHI KIM MxOy + yH2 xM + yH2O ( ĐK M: từ Zn Au trong dãy hoạt động hóa học) VD: Fe2O3 + 3H2 2Fe + 3H2O Nhớ: 2FeO + 1/2O2Fe2O3 3 BAZO TÁC DỤNG VỚI PHI KIM Cl 2 NaOH NaCl NaClO + Ca(OH) CaOCl + H O 2 H O 2 2 Níc ja ven Cl 2 2 2 clo rua v«i KIẾN THỨC HS CẦN NHỚ:- Tại sao nước ja ven và Clo rua vôi có tính tẩy màu? HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 3 Vì trong không khí sẽ có CO2 => 3 3 2 2 3 H HCO 2 2 2 2 3 2 H HCO NaClO CO H O NaHCO HClO HCl + O OXH m¹nh 2CaOCl 2CO 2H O CaCl Ca(HCO ) 2HClO HCl + O OXH m¹nh Trong CN ngêi ta §/C níc ja ven bºng c¸ch => ®pdd NaCl §pdd 2 2 2 A( ) K( ) NaCl + H O Cl H NaOH 4 PHI KIM TÁC DỤNG VỚI MUỐI 2FeCl2 + 3Cl2 2FeCl3 5 PHI KIM TÁC DỤNG VỚI H 2 O F2 + H2OHF + O2 ( phản ứng c/m F2 có tính OXH mạnh hơn O2) BÀI TẬP ÁP DỤNG A. BÀI TẬP VỀ LÝ THUYẾT. I. MỨC ĐỘ DỄ ( 1 => 4) Câu 1: Oxit dễ bị H2 khử ở nhiệt độ cao tạo thành kim loại là A. CaO. B. Na2O. C. K2O. D. CuO. Câu 2: Chất không khử được sắt oxit ( ở nhiệt độ cao) là A. Cu. B. Al. C. CO. D. H2. Câu 3: Khi cho Fe tác dụng chất X thu được FeX3. X là A. S. B. HCl. C. Br2. D. H2SO4. Câu 4: Oxit nào sau đâu không phải là Oxit Bazo? A. CuO. B. CrO3. C.FeO. D. ZnO. Câu 5: Trong phòng thí nghiệm, để điều chế một lượng nhỏ khí X tinh khiết, người ta đun nóng dung dịch amoni nitrit bão hoà. Khí X là: A. NO. B. NO2. C. N2O. D. N2. Câu 6: CTPT của Clorua vôi là A. CaCl2. B. NaClO. C. Ca(ClO2)2. D. CaOCl2. Câu 7: Phát biểu nào dưới đây là đúng (giả thiết các phản ứng đều hoàn toàn)? A. 0,1 mol Cl2 tác dụng với dd NaOH dư tạo 0,2 mol NaClO B. 0,3 mol Cl2 tác dụng với dd KOH dư (70 OC) tạo 0,1mol KClO3 C. 0,1 mol Cl2 tác dụng với dd Na2SO3 dư tạo 0,2 mol Na2SO4 D. 0,1 mol Cl2 tác dụng với dd SO2 dư tạo 0,2 mol H2SO4. Câu 8: Phản ứng chứng minh nước ja ven có tính tẩy màu là A. 3 2 2 3 H HCO NaClO CO H O NaHCO HClO B. Cl 2 NaOH NaCl NaClO H O 2 2 C. + Ca(OH) CaOCl + H O 2 2 2 Cl 2 D. §pdd 2 2 2 NaCl + H O Cl H NaOH Câu 9: Nước Gia-ven và clorua vôi thường được dùng để A. sản xuất clo trong công nghiệp. B. tẩy trắng sợi, vải, giấy và tẩy uế. HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 4 C. sản xuất HCl trong phòng thí nghiệm. D. sản xuất phân bón hóa học. Câu 10: Cho các chất: N2, H2S, SO2, HBr, CO2. Có bao nhiêu chất có phản ứng với O2 ở điều kiện thích hợp ? A. 4. B. 3. C. 5. D. 2. II. MỨC ĐỘ TB( 4 => 8) Câu 11: Dãy gồm các chất đều tác dụng (trong điều kiện phản ứng thích hợp) với lưu huỳnh là: A. H2, Pt, F2. B. Zn, O2, F2. C. Hg, O2, HCl. D. Na, Br2, H2SO4 loãng. Câu 12: Ứng dụng nào sau đây không phải của khí SO2? A. Sản xuất axit sunfuric. B. Tẩy trắng giấy, bột giấy. C. Khử trùng nước sinh hoạt. D. Chống nấm mốc cho lương thực, thực phẩm. Câu 13: Cho các chất: S, SO2, H2S, HI, FeS2, Ag, Au lần lượt vào H2SO4 đặc, nóng. Có bao nhiêu chất xảy ra phản ứng? A. 3. B. 5. C. 6. D. 4. Câu 14: Cho các chất tham gia phản ứng: (1): S+ F2 (2): SO2 + H2S (3): SO2 + O2 (4):S+H2SO4(đặc,nóng) (5): H2S + Cl2 (dư ) + H2O (6): FeS2 + HNO3 Khi các điều kiện xúc tác và nhiệt độ có đủ, số phản ứng tạo ra sản phẩm mà lưu huỳnh ở mức số oxi hoá +6 là A. 4. B. 5. C. 2. D. 3. Câu 15: Cho các thí nghiệm sau: 1. Thổi O3 vào dung dịch KI + hồ tinh bột 2.Cho dung dịch Br2 loãng vào dung dịch KI + hồ tinh bột 3. Cho dung dịch FeCl3 vào dung dịch KI + hồ tinh bột 4. Cho I2 vào dung dịch hồ tinh bột Số thí nghiệm làm dung dịch xuất hiện màu xanh là: A. 1 B. 2 C. 3 D. 4 Câu 16: Một phòng bị ô nhiễm bởi một lượng khí Cl2. Để làm sạch bằng phương pháp hóa học, chọn giải pháp đúng: A. Bơm thêm khí H2 vào phòng B. Bơm thêm khí O3 vào phòng C. Bơm thêm khí NH3 vào phòng D. Bơm thêm khí CH4 vào phòng Câu 17: Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiêm như sau: Dung dịch X là: A.NaCl B.KMnO4 C.KClO3 D.HCl Dd X NaCl dd H2SO4 đặc Dd HCl đặc Eclen sạch để thu khí Clo 1 HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 5 Câu 18: Cho 1 luồng khí H2 dư lần lượt đi qua các ống mắc nối tiếp đựng các oxit nung nóng như hình vẽ sau: CaO CuO ZnO Fe2O3 Na2O Ở ống nào có phản ứng xảy ra: A. Ống 2, 4. B. Ống 2, 3, 4, 5. C. Ống 1, 2, 3. D. Ống 2, 4, 5. Câu 19: Cho các cặp chất sau: (a) Khí Cl2 và khí O2. (b) Khí H2S và khí SO2. (c) Khí H2S và dung dịch Pb(NO3)2. (d) CuS và dung dịch HCl. (e) Khí Cl2 và NaOH trong dung dịch. Số cặp chất có khả năng phản ứng được với nhau ở nhiệt độ thường là: A. 3. B. 2. C. 1. D. 4. Câu 20: Có các nhận xét sau về N và hợp chất của nó: 1) N2 tương đói trơ về hoạt dộng hóa học ở điều kiện thường vì trong phân tử có một liên kết ba bền. 2)Khí NH3 tan tốt trong H2O tạo được dung dịch có môi trường bazơ. 3)HNO3 được tạo ra khi cho hỗn hợp khí (NO2 và O2) sục vào H2O. 4)Khi phản ứng với Fe2O3 thì HNO3 đóng vai trò là chất oxi hóa. 5)Khi sục khí NH3 đến dư vào dung dịch CuSO4 thì sau phản ứng hoàn toàn thu dược kết tủa màu xanh. 6) Trong công nghiệp NH3 được tạo ra khi cho N2 phản ứng với H2. Trong các nhận xét trên số nhận xét đúng là: A.2 B.3 C.4 D.5 B. BÀI TẬP TÍNH TOÁN I. MỨC ĐỘ DỄ( 1 => 4) Câu 21: Cho 11,2 gam Fe tác dụng vừa đủ với V(l) khí Cl2. Giá trị V là A. 3,36 B. 4,48 C. 6,72 D. 8,96 Câu 22: Cho 16 gam Fe2O3 tác dụng với H2(dư), thu được m(g) Fe. Giá trị m là A. 5,6 B. 11,2 C. 16,8 D. 22,4 Câu 23: Cho 5,4 gam Al tác dụng với 3,36 lít khí Cl2(đktc), thu được m(g). Giá trị m là A. 15,62 B. 12,65 C. 16,25 D. 16,52 Câu 24: Khử hoàn toàn 17,4 gam Oxit kim loại M cần 6,72 lít khí H2. CT của Oxit là A. FeO B. Fe2O3 C. MgO D. Fe3O4 Câu 25: Oxi hóa hoàn toàn 8,3 gam hỗn hợp gồm Fe và Al cần vừa đủ 6,72 lít O2, thu được hỗn hợp gồm Fe2O3 và Al2O3. Phần trăm về số mol của Fe trong hỗn hợp đầu là A. 50% B. 40% C. 30% D. 75% Câu 26: Thể tích khí clo (đktc) cần dùng để phản ứng hoàn toàn với 5,4 gam Al là A. 3,36 lít. B. 8,96 lít. C. 2,24 lít. D. 6,72 lít. Câu 27: Hòa tan hoàn toàn m gam kim loại X bằng dung dịch HCl sinh ra V lít khí (đktc); cũng m gam X khi đun nóng phản ứng hết với V lít O2 (đktc). Kim loại X là : A. Zn. B. Ni. C. Pb. D. Sn. Câu 28: Khử hoàn toàn 40,1 gam hỗn hợp gồm Fe2O3, CuO, ZnO cần dùng vừa đủ 13,44 lit khí H2 (đktc). Khối lượng chất rắn thu được sau phản ứng là A. 50,3g B. 3,05g C. 5,03g D. 30,5g Câu 29: Cho khí H2 khử hoàn toàn đến Fe một hỗn hợp gồm: FeO, Fe2O3, Fe3O4 thấy có 4,48 lít H2O (đktc) thoát ra. Thể tích H2 (đktc) đã tham gia phản ứng là: A. 2,24 lít B. 4,48 lít. C. 1,12 lít. D. 3,36 lít. 1 2 3 4 5 HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 6 Câu 30: Khử hoàn toàn 32 gam hỗn hợp CuO và Fe2O3 bằng khí H2, thấy tạo ra 9 gam nước. Khối lượng hỗn hợp kim loại thu được là A. 12 gam. B. 16 gam. C. 24 gam D. 26 gam. Câu 31: Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2 qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là bao nhiêu? A. 21,6 gam. B. 22,4 gam. C. 23,2 gam. D. 20,8 gam Câu 32: Cho V lít hỗn hợp khí (ở đktc) gồm CO và H2 phản ứng với lượng dư hỗn hợp rắn gồm CuO, MgO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là A. 0,560 B. 0,448 C. 0,112 D. 0,224 Câu 33: Nung m gam Cu trong oxi thu được hỗn hợp chất rắn X có khối lượng 24,8 gam gồm Cu2O, CuO, Cu. Hòa tan hoàn toàn X trong dung dịch H2SO4 đặc nóng thu được 4,48 lit khí SO2 (đktc). Giá trị của m là A. 2,24. B. 22,4. C. 32. D. 6,4. Câu 34: Cho 7,84 lit (đktc) hỗn hợp khí oxi và clo tác dụng vừa đủ với hỗn hợp chúa 0,1 mol Mg và 0,3 mol Al thu được m (gam) hỗn hợp muối clorua và oxit. Giá trị của m là: A. 21,7. B. 35,35. C. 27,55. D. 29,5. Câu 35: Đốt 24 gam hỗn hợp X gồm Fe và Cu trong không khí thu được m gam hỗn hợp chất rắn Y gồm Fe, Cu, CuO, Fe3O4. Cho hỗn hợp Y vào dung dịch H2SO4 đặc, nóng thu được 6,72 lít SO2 (đktc) và dung dịch có chứa 72 gam muối sunfat. Xác định m? A. 25,6 B. 28,8 C. 27,2 D. 26,4 Câu 36: Cho 8,654 gam hỗn hợp khí Cl2 và O2 tác dụng vừa đủ với 0,396 mol hỗn hợp Y gồm Mg, Zn, Al thì thu được 23,246 gam hỗn hợp muối clorua và oxit của 3 kim loại. Cho Z phản ứng vừa đủ với V ml dung dịch HCl 1M thì thu được dung dịch T. Cho từ từ dung dịch Ba(OH)2 2M vào T đến khi lượng kết tủa thu được không thay đổi về khối lượng thì cần vừa đủ 286 ml. Giá trị của V là A. 780 B. 864 C. 572 D. 848 Câu 37: Nung 3,2 gam hỗn hợp gồm Fe và kim loại R chỉ có hóa trị (II) với 1,6 gam bột lưu huỳnh được hỗn hợp rắn X. Hòa tan hoàn toàn lượng X trong dung dịch HCl được dung dịch Y và hỗn hợp khí Z. Cho dung dịch Y tác dụng vừa đủ với NaOH để thu được kết tủa lớn nhất. Đem nung nóng kết tủa trong không khí đến khối lượng không đổi được 4,8 gam hỗn hợp oxit. Để đốt cháy hoàn toàn hỗn hợp khí Z cần 0,09 mol O2. R là: A. Zn. B. Ni. C. Be. D. Mg. Câu 38: Để m gam phôi bào sắt ngoài không khí, sau một thời gian thu được hỗn hợp X gồm 4 chất có khối lượng là 20 gam. Hòa tan hết X trong 500 ml dung dịch HCl nồng độ a mol/l thấy thoát ra 2,24 lít (đktc) H2 và dung dịch Y (không có HCl dư). Cho tiếp dung dịch HNO3 tới dư vào dung dịch Y thu được dung dịch Z (chứa FeCl3, Fe(NO3)3 và HNO3 dư) và 2,24 lít (đktc) NO duy nhất. Giá trị của m và a lần lượt là A. 15,68 và 0,4. B. 15,68 và 1,48. C. 16,8 và 0,4. D. 16,8 và 1,2. Câu 39: Hỗn hợp X có khối lượng 8,14 gam gồm CuO, Al2O3 và một oxit sắt. Cho H2 dư qua X đun nóng, sau khi phản ứng thu được 1,44 gam H2O. Hoà tan hoàn toàn X cần dùng 170 ml dung dịch H2SO4 loãng 1M, thu được dung dịch Y. Cho Y tác dụng với dung dịch NaOH dư, lọc lấy kết tủa, đem nung trong không khí tới khối lượng không đổi, thu được 5,2 gam chất rắn. Công thức oxit của sắt là A. FeO. B. Fe2O3. C. Fe3O4. D. Fe3O4 hoặc Fe2O3. Câu 40: Dẫn 0,5 mol hỗn hợp khí gồm H2 và CO có tỉ khối so với H2 là 4,5 qua ống đựng 0,4 mol Fe2O3 và 0,2 mol CuO đun nóng. Sau phản ứng hoàn toàn cho chất rắn trong ống vào dung dịch HNO3 loãng, dư thu được V lít khí NO (sản phẩm khử duy nhất, đktc). Giá trị của V là A. 20,907 lít. B. 3,730 lít. C. 34,720 lít. D. 7,466 lít. HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 7 ĐÁP ÁN 01. D 02. A 03. C 04. B 05. D 06. D 07. B 08. A 09. B 10. A 11. B 12. C 13. B 14. A 15. D 16. C 17. A 18. B 19. A 20. C 21. C 22. B 23. C 24. D 25. B 26. D 27. D 28. D 29. B 30. C 31. B 32. B 33. B 34. C 35. C 36. A 37. D 38. D 39. C 40. D HƯỚNG DẪN GIẢI CHI TIẾT Câu 1: Chọn đáp án D Câu 2: Chọn đáp án A Câu 3: Chọn đáp án C Câu 4: Chọn đáp án B Câu 5: Chọn đáp án D Câu 6: Chọn đáp án D Câu 7: Chọn đáp án B (A)Sai vì tạo 0,1 NaClO (B) Đúng 3 KClO : 0,1 KCl : 0,5 BTE : 0,1.( 5) 0,5( 1) 0 (C) 2 3 2 2 2 4 Na SO Cl H O Na SO 2HCl (D) 2 2 2 2 4SO Cl 2H O 2HCl H SO Câu 8: Chọn đáp án A Câu 9: Chọn đáp án B Câu 10: Chọn đáp án A Bao gồm các chất : N2, H2S, SO2, HBr (1) 03000 C 2 2N O 2NO (2) 2 2 2 2 2H S 3O 2SO 2H O (3) 0xt,t 2 2 3 1 SO O SO 2 (4) 2 2 24HBr O 2H O 2Br Câu 11: Chọn đáp án B A. H2, Pt, F2. Pt không phản ứng với S B. Zn, O2, F2. C. Hg, O2, HCl. HCl không phản ứng với S D. Na, Br2, H2SO4 loãng. H2SO4 loãng không phản ứng với S Câu 12: Chọn đáp án C A. Sản xuất axit sunfuric. Đúng theo SGK lớp 10 B. Tẩy trắng giấy, bột giấy. Đúng theo SGK lớp 10 C. Khử trùng nước sinh hoạt. Sai.Khử trùng dùng Clo hoặc Ozon D. Chống nấm mốc cho lương thực, thực phẩm. Đúng theo SGK lớp 10 Câu 13: Chọn đáp án B S ; H2S ; HI; FeS2; Ag 2 4 2 2 S 2H SO 3SO 2H O 2 4 2 2 2 4 2 2 2 H SO 3H S 4S 4H O 3H SO H S 4SO 4H O 2 4 2 2 28HI H SO dac H S 4I 4H O HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 8 2 2 4 2 4 2 232FeS 14H SO Fe SO 15 SO 14H O 2 4 2 4 2 2 2Ag 2H SO Ag SO SO 2H O Câu 14: Chọn đáp án A Các phản ứng thỏa mãn : (1) (3) (5) (6) (1) 2 6 S 3F SF (2) 2 2 23 2 SO H S S H O (3) 2 2 3 1 2 SO O SO (4) 2 4 2 2 S 2H SO 3SO 2H O (5) 2 2 2 2 4 SO Cl 2H O H SO 2HCl (6) 2 3 3 2 4 2 23FeS 18HNO Fe NO 2H SO 15NO 7H O Câu 15: Chọn đáp án D Câu 16: Chọn đáp án C Câu 17: Chọn đáp án A Câu 18: Chọn đáp án B Câu 19: Chọn đáp án A (a) Khí Cl2 và khí O2. Không xảy ra phản ứng kể cả ở nhiệt độ cao. (b) Khí H2S và khí SO2. Có xảy ra phản ứng : 2 2 2 2H S O 2S 2H O (c) Khí H2S và dung dịch Pb(NO3)2. Có xảy ra phản ứng : 2 2 H S Pb PbS 2H (d) CuS và dung dịch HCl. Không xảy ra phản ứng (e) Khí Cl2 và NaOH trong dung dịch. Có xảy ra phản ứng : ot thuong 2 2 Cl 2NaOH NaCl NaClO H O Câu 20: Chọn đáp án C 1) N2 tương đói trơ về hoạt dộng hóa học ở điều kiện thường vì trong phân tử có một liên kết ba bền.(Đúng) 2)Khí NH3 tan tốt trong H2O tạo được dung dịch có môi trường bazơ.(Đúng) 3)HNO3 được tạo ra khi cho hỗn hợp khí (NO2 và O2) sục vào H2O.(Đúng) 4)Khi phản ứng với Fe2O3 thì HNO3 đóng vai trò là chất oxi hóa.(Sai) 5)Khi sục khí NH3 đến dư vào dung dịch CuSO4 thì sau phản ứng hoàn toàn thu dược kết tủa màu xanh.(Sai tạo phức) 6) Trong công nghiệp NH3 được tạo ra khi cho N2 phản ứng với H2.(Đúng) Câu 21: Chọn đáp án C Câu 22: Chọn đáp án B Câu 23: Chọn đáp án C Câu 24: Chọn đáp án D Câu 25: Chọn đáp án A Câu 26: Chọn đáp án D Câu 27: Chọn đáp án D Câu 28: Chọn đáp án D Câu 29: Chọn đáp án B Câu 30: Chọn đáp án C Câu 31: Chọn đáp án B HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 9 Vì lượng oxit dư nên toàn bộ lượng CO và H2 đều phản ứng hết Mỗi phân tử CO và H2 đều nhận thêm 1 nguyên tử O hình thành CO2 và H2O → nO = nH2 + nCO2 = 0,1 mol Sử dụng tăng giảm khối lượng → m chất rắn = mhỗn hợp - mO = 24- 16. 0,1 = 22, 4 gam => Đáp án B. Câu 32: Chọn đáp án B => Chọn B Câu 33: Chọn đáp án B Gọi số mol của Cu và O lần lượt là x, y mol Ta có hệ → m= 0,35. 64 = 22,4 gam. Đáp án B. Câu 34: Chọn đáp án C Câu 35: Chọn đáp án C Câu 36: Chọn đáp án A Câu 37: Chọn đáp án D Vì sau phản ứng thu được hỗn hợp khí Z→ S phản ứng hết tạo mối muối sunfua → nH2S = nS = 0,05 mol Đốt cháy hỗn hợp Z cần 0,09 mol O2 → nH2 = = 0,03 mol Bảo toàn electron → nFe + nR = nH2 + nH2S → x+ y = 0,08 mol Sử dụng tăng giảm khối lượng → 1,5x. 16 + 16y = 4,8 - 3,2 Giải hệ → x = y = 0,04 56. 0,04 + 0,04. R = 3,2 → R = 24 ( Mg) => Đáp án D. Câu 38 : Chọn đáp án D Coi hỗn hợp X gồm Fe và O: bảo toàn e: =>Chọn D Câu 39: Chọn đáp án C Câu 40: Chọn đáp án D HÓA HỌC TỪ GỐC TÀI LIỆU ÔN THI THPT QG NĂM 2016 BIÊN SOẠN: NGUYỄN VĂN XÔ 10 NGÀY 2: THỰC HIỆN CÁC MỤC SAU: 6,7,8,9,10 6 KIM LOẠI TÁC DỤNG VỚI OXIT PHI KIM 7 OXIT KIM LOẠI TÁC DỤNG VỚI OXIT PHI KIM 8 BAZO TÁC DỤNG VỚI OXIT PHI KIM 9 MUỐI TÁC DỤNG VỚI OXIT PHI KIM 10 H2O TÁC DỤNG VỚI OXIT PHI KIM
Tài liệu đính kèm:
 ON_LUYEN_HOA_HOC_TU_GOC_CAN_TU_VAN_LIEN_HE_0988722293.pdf
ON_LUYEN_HOA_HOC_TU_GOC_CAN_TU_VAN_LIEN_HE_0988722293.pdf





