Kỳ thi olympic tháng 4 TPHCM lần 1 năm học 2014-2015 môn thi: Hoá học 11
Bạn đang xem tài liệu "Kỳ thi olympic tháng 4 TPHCM lần 1 năm học 2014-2015 môn thi: Hoá học 11", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
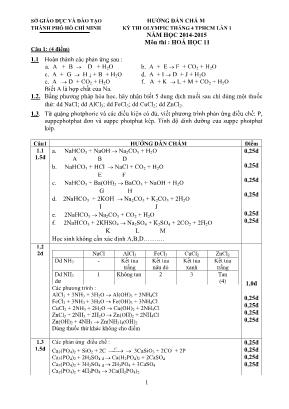
1 SỞ GIÁO DỤC VÀ ĐÀO TẠO HƯỚNG DẪN CHẤ M THÀNH PHỐ HỒ CHÍ MINH KỲ THI OLYMPIC THÁNG 4 TPHCM LẦN 1 NĂM HỌC 2014-2015 Môn thi : HOÁ HỌC 11 Câu 1: (4 điểm) 1.1 Hoàn thành các phản ứng sau : a. A + B D + H2O b. A + E F + CO2 + H2O c. A + G H + B + H2O d. A + I D + J + H2O e. A D + CO2 + H2O f. A + K L + M + CO2 + H2O Biết A là hợp chất của Na. 1.2. Bằng phương pháp hóa học, hãy nhận biết 5 dung dịch muối sau chỉ dùng một thuốc thử: dd NaCl; dd AlCl3; dd FeCl3; dd CuCl2; dd ZnCl2. 1.3. Từ quặng photphoric và các điều kiện có đủ, viết phương trình phản ứng điều chế: P, suppephotphat đơn và suppe photphat kép. Tính độ dinh dưỡng của suppe photphat kép. Câu1 HƯỚNG DẪN CHẤM Điểm 1.1 1.5đ - a. NaHCO3 + NaOH Na2CO3 + H2O - A B D - b. NaHCO3 + HCl NaCl + CO2 + H2O - E F - c. NaHCO3 + Ba(OH)2 BaCO3 + NaOH + H2O - G H - d. 2NaHCO3 + 2KOH Na2CO3 + K2CO3 + 2H2O - I J - e. 2NaHCO3 Na2CO3 + CO2 + H2O - f. 2NaHCO3 + 2KHSO4 Na2SO4 + K2SO4 + 2CO2 + 2H2O - K L M - Học sinh không cần xác định A,B,D. 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 1.2 2đ NaCl AlCl3 FeCl3 CuCl2 ZnCl2 Dd NH3 - Kết tủa trắng Kết tủa nâu đỏ Kết tủa xanh Kết tủa trắng Dd NH3 dư 1 Không tan 2 3 Tan (4) Các phương trình : AlCl3 + 3NH3 + 3H2O Al(OH)3 + 3NH4Cl FeCl3 + 3NH3 + 3H2O Fe(OH)3 + 3NH4Cl CuCl2 + 2NH3 + 2H2O Cu(OH)2 + 2NH4Cl ZnCl2 + 2NH3 + 2H2O Zn(OH)2 + 2NH4Cl Zn(OH)2 + 4NH3 Zn(NH3)4(OH)2 Dùng thuốc thử khác không cho điểm 1,0đ 0,25đ 0,25đ 0,25đ 0,25đ 1.3 1.5đ Các phản ứng điều chế : Ca3(PO4)2 + SiO2 + 2C 0 t 3CaSiO3 + 2CO + 2P Ca3(PO4)2 + 2H2SO4 đ Ca(H2PO4)2 + 2CaSO4 Ca3(PO4)2 + 3H2SO4 đ 2H3PO4 + 3CaSO4 Ca3(PO4)2 + 4H3PO4 3Ca(H2PO4)2 0,25đ 0,25đ 0,25đ 0,25đ 2 Supephotphatkep Ca(H2PO4)2 P2O5 234 142 Độ dinh dưỡng là : 100 234 142 . = 60,68% 0,25đ 0,25đ Câu 2: (5 điểm) 2.1. Công thức phân tử chung của 3 chất hữu cơ (X), (Y), (T) đều có dạng (CH)n. Biết rằng : (X) (Y) (Y1) cao su buna (X) (T) o 2 Br ,xt,t (T1) o NaOH 200atm,300 C (T2) (T3) axit picric Xác định công thức cấu tạo của 3 chất (X), (Y), (T) và viết các phương trình phản ứng 2.2. Có phản ứng sau : X + H2 (dư) 3-metylbutan-1-ol. Xác định các công thức có thể có của X và viết các phản ứng xảy ra. 2.3. X là chất hữu cơ, đốt cháy X chỉ thu được CO2 và H2O biết MX < 60. Mặt khác khi cho X tác dụng với AgNO3/NH3 (dư) thì tỷ lệ mol phản ứng là nX: nAgNO3 = 1:2. Viết các công thức cấu tạo có thể có của X. Câu2 HƯỚNG DẪN CHẤM Điểm 2.1 2đ X: HCCH ; Y: H2C=CH-CCH ; T: C6H6 2CHCH o xt,t CH2=CH-CCH CH2=CH-C CH + H2 o 3 Pd/PbCO ,t CH2=CH-CH=CH2 nCH2=CH-CH=CH2 o xt,t ,p CH2-CH=CH-CH2 n 3HCCH o xt,t C6H6 C6H6 + Br2 o Fe,t C6H5Br + HBr C6H5Br + 2NaOHđặc o 300 C;200atmC6H5ONa + NaBr + H2O C6H5ONa + HCl C6H5OH + NaCl C6H5OH + 3HNO3 o 2 4 H SO ,t C6H2OH(NO2)3 + 3H2O 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 2.2 1.25 TH1: X là ancol CH2= C(CH3)-CH2CH2OH + H2 0 t,Ni CH3CH(CH3)CH2CH2OH CH3 C(CH3)=CHCH2OH + H2 0 t,Ni CH3CH(CH3)CH2CH2OH TH1: X là andehyt CH3CH(CH3)CH2CHO + H2 0 t,Ni CH3CH(CH3)CH2CH2OH CH2= C(CH3)-CH2CHO + 2H2 0 t,Ni CH3CH(CH3)CH2CH2OH CH3 C(CH3)=CHCHO +2 H2 0 t,Ni CH3CH(CH3)CH2CH2OH 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 2.3. 1.75đ Đốt cháy X chỉ thu được CO2 và H2O X chứa C,H hoặc C,H,O Mặt khác X tác dụng với AgNO3/NH3, tỷ lệ mol là 1:2 X có 1 nhóm –CHO hoặc có 2 liên kết ba đầu mạch. Do MX<60. X có thể là: HCCH; HCC- CCH; CH3CHO; CH3CH2CHO; CH2= CHCHO; HCOOH. 0,25đ 0,25đ 1.25đ 3 Câu 3: ( 5 điểm) 3.1. Đốt cháy hoàn toàn 4,4 gam sunfua của kim loại M (công thức MS) trong oxi dư. Chất rắn sau phản ứng đem hòa tan trong một lượng vừa đủ dung dịch HNO3 37,8% thấy nồng độ phần trăm của muối trong dung dịch thu được là 41,72%. Khi làm lạnh dung dịch này thì thoát ra 8,08 gam muối rắn. Lọc tách muối rắn thấy nồng độ phần trăm của muối trong dung dịch là 34,7%. Xác định công thức của muối rắn 3.2. Hòa tan x gam hỗn hợp bột gồm 2 kim loại Mg và Al vào y gam dung dịch HNO3 24%. Sau phản ứng thu được dung dịch A và 0,896 lít hỗn hợp X gồm 3 khí không màu có khối lượng 1,32 gam. Thêm một lượng O2 vừa đủ vào X, phản ứng xong thu được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch NaOH dư thấy còn lại khí Z (có tỉ khối hơi của Z so với H2 bằng 18). Nếu cho từ từ dung dịch NaOH vào dung dịch A đến khi thu được lượng kết tủa lớn nhất thấy cân nặng 6,42 gam (không có khí thoát ra).Tính x và y biết rằng HNO3 đã lấy dư 15% so với lượng cần thiết, các thể tích khí đều đo ở điều kiện tiêu chuẩn và các phản ứng đều xảy ra hoàn toàn. Câu HƯỚNG DẪN CHẤM Điểm 3.1 2.5đ MS a mol Ma + 32a = 4,4 (I) 2MS + (0,5n+2) O2 M2On + 2SO2 (1) a a/2 (mol) M2On + 2nHNO3 2M(NO3)n + nH2O (2) a/2 na a (mol) mdd HNO3= 3 500na ; C% (muôi)= 3 500 8 62 na naMa naMa .100= 41,72 (II) Từ (II) M = n 3 56 . Vậy M là Fe; a=0,05. Từ các dữ kiện trên ta có khối lượng dung dịch thu được trước khi làm lạnh là: m = Ma + 8na + 166,67na = 29 (gam) Sau khi làm lạnh, khối lượng dung dịch là : 29 – 8,08 = 20,92 (gam) Số mol của Fe(NO3)3 trong dung dịch sau khi làm lạnh là Mol Fe(NO3)3 = 242100 7349220 . ,., =0,03 mol Fe(NO3)3 trong muối rắn = 0,02. 242 + 18m = 404 m =9 Vậy CT của muối Fe(NO3)3.9H2O 0,25đ 0,25đ 0,25đ 0,5đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 3.2 2.5đ X 1,32 M 33 0,04 mà X tác dụng được với O2 → trong X phải chứa NO. Mặt khác ZM 18.2 36 → trong Z có 2 khí là N2 và N2O. Vậy trong X có 3 khí là N2 (a mol), NO (b mol), N2O (c mol). Ta có hệ phương trình 2 2N N O Z a b c 0,04 28a 30b 44c 1,32 M M a c (vì M ) 2 → a 0,01 b 0,02 c 0,01 0,25đ 0,25đ 0,25đ 0,5đ 4 Các quá trình oxi hoá và quá trình khử Mg Mg 2+ + 2e 12H + + 2NO3 - + 10e N2 + 6H2O x 2x 0,12 0,1 0,01 mol Al Al 3+ + 3e 10H + + 2NO3 - + 8e N2O+ 5H2O y 3y 0,1 0,08 0,01 mol 4H + + NO3 - + 3e NO+ 2H2O 0,08 0,06 0,02 mol Ta có 2x 3y 0,24 58x 78y 6,42 → x 0,03 y 0,06 → x = mhh = mMg + mAl = 2,34 (g) Mol HNO3= mol H + = 0,12 + 0,1 + 0,08 = 0,3 (mol) y = 3ddHNO can 0,3.115.63.100 m 90,5625(g) 100.24 0,5đ 0,25đ 0,25đ 0,25đ Câu 4: (5 điểm) 4.1. Oxi hóa 0,08 mol một ancol đơn chức, thu được hỗn hợp X gồm một axit cacboxylic, một andehyt, ancol dư và nước. Ngưng tụ toàn bộ X rồi chia làm hai phần bằng nhau. Phần một cho tác dụng hết với Na dư thu được 0,504 lít khí H2 (đktc). Phần hai cho phản ứng tráng Ag hoàn toàn thu được 9,72 gam Ag. Phần trăm khối lượng ancol bị oxi hóa là. 4.2. A là axit hữu cơ mạch không phân nhánh, B là ancol đơn chức bậc 1 có nhánh. Khi trung hòa hoàn toàn A cần số mol NaOH gấp 2 lần số mol A. Khi đốt cháy B được CO2 và H2O với tỉ lệ số mol 4:5. Khi cho 0,1 mol A tác dụng với 0,25 mol B với hiệu suất 73,5% thu được 14,847 gam chất hữu cơ E. 1) Viết công thức cấu tạo của A, B, E. 2) Tính khối lượng axit A và ancol B đã tham gia phản ứng Câu HƯỚNG DẪN CHẤM Điểm 4.1. 2đ Đặt công thức của ancon đơn chức là RCH2OH Hỗn hợp X gồm RCHO a mol RCOOH b mol RCH2OH dư c mol H2O (a+b) mol Giả thuyết ta có a + b + c = 0,08 (1) Cho tác dụng với Na ta có : b + c + a + b = 0,09 (2) (1) và (2) b=0,01 (mol) Cho phản ứng tráng bạc: 2a = 0,18 a= 0,09 (vô lý) Vậy R=1 X gồm HCHO a; HCOOH b; Khi tráng Ag sẽ cho 4a + 2b = 0,18 a=0,04 (mol) % ancol bị oxy hóa là: 080 040010 , ,, .100= 62,5% 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 5 4.2. 3đ 1) Ancol đơn chức B đốt cháy có 2 2 CO H O n n = 4 5 nCO2 < nH2O , vậy B là ancol đơn chức no mạch hở : CnH2n+2O CnH2n+2O + 3n 2 O2 n CO2 + (n +1) H2O Ta có tỉ lệ 2 2 CO H O n n = n n 1 = 4 5 n = 4 : C4H10O hay C4H9-OH B có cấu tạo mạch cacbon phân nhánh : CH3CH(CH3)CH2OH Đặt công thức phân tử A : R(COOH)m Theo gt : NaOH A n n = 2 m = 2, công thức phân tử A có dạng : R(COOH)2 Xét 2 trường hợp este hóa giữa A và B: TH1: A bị este hóa cả 2 chức: R(COOH)2 + 2C4H9-OH R(COO-C4H9)2 + 2H2O Khối lượng mol phân tử este: M= 14,847 0,1 0,735 = 202 Từ công thức este: M = R +202 = 202 R = 0 Công thức của A : (COOH)2 hay HOOC-COOH Công thức cấu tạo của este E : COO CH 2 CH CH 3 COO CH 2 CH CH 3 CH 3 CH 3 TH2: A bị este hóa một chức: R(COOH)2 + C4H9-OH R(COOH) (COO-C4H9) + H2O M = R + 146 = 202 R = 56 (-C4H8-) Công thức phân tử của A : C4H8(COOH)2 : HOOC-CH2-CH2-CH2-CH2-COOH : Công thức cấu tạo của este E : 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 6 CH 2 CH 2 COO CH 2 CH CH 3 CH 2 CH 2 COOH CH 3 2) Khối lượng A, B đã phản ứng : a) A tạo este 2 chức: mA = 14,847×90 202 = 6,615 gam mB = 14,847×74×2 202 = 10,878 gam b) A tạo este 1 chức : mA’ = 14,847×146 202 = 10,731 gam mB’ = 14,847×74 202 = 5,439 gam 0,25đ 0,25đ 0,25đ
Tài liệu đính kèm:
 Olympiclan1lop1120142015tpHCMdap_an.pdf
Olympiclan1lop1120142015tpHCMdap_an.pdf





