Kiểm tra học kì II môn Hóa học 8 Trường thcs Hải Trạch
Bạn đang xem tài liệu "Kiểm tra học kì II môn Hóa học 8 Trường thcs Hải Trạch", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
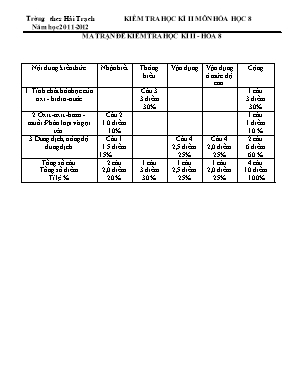
Trêng thcs H¶i Tr¹ch KIỂM TRA HỌC KÌ II MÔN HÓA HỌC 8 Năm học 2011-2012 MA TRẬN ĐỀ KIỂM TRA HỌC KÌ II - HÓA 8 Nội dung kiến thức Nhận biết Thông hiểu Vận dụng Vận dụng ở mức độ cao Cộng 1. Tính chất hóa học của oxi - hidro-nước Câu 3 3 điểm 30% 1 câu 3 điểm 30% 2. Oxit -axit -bazơ - muối: Phân loại và gọi tên Câu 2 1.0 điểm 10% 1 câu 1 điểm 10 % 3.Dung dịch, nồng độ dung dịch Câu 1 1.5 điểm 15% Câu 4 2,5 điểm 25% Câu 4 2,0 điểm 25% 2 câu 6 điểm 60 % Tổng số câu Tổng số điểm Tỉ lệ % 2 câu 2,0 điểm 20 % 1 câu 3 điểm 30 % 1 câu 2,5 điểm 25% 1 câu 2,0 điểm 25% 4 câu 10 điểm 100% ĐỀ KIỂM TRA HỌC KÌ II - MÔN HÓA 8 Đề 1 Câu 1: ( 1,5 đ) Thế nào là dung môi, chất tan, dung dịch. Mỗi khái niệm cho một ví dụ? Câu 2: ( 1.0 đ) a. Gọi tên các chất có công thức hóa học sau: Fe2O3, HNO3 b.Viết công thức hóa học của các chất có tên gọi sau đây: Đồng (II) hidroxit; Sắt (II) sunfat. Câu 3: ( 3.0 đ)Lập các PTHH của các phản ứng có sơ đồ sau: a. KClO3 ? + ? b. Na2O + ? NaOH c. PbO + H2 ? + ? d. ? + H2SO4 MgSO4 + H2 e. Lưu huỳnh đi oxit + Nước Axit sun furrơ f. Kim loại nhôm + Khí oxi Nhôm oxit Câu 4: ( 4.5 đ) Thả một viên kẽm vào 200 ml dung dịch axit clohidric, phản ứng xảy ra hoàn toàn thu được muối kẽm clorua và 4,48 lit khí hidro (đktc) Nêu hiện tượng xãy ra, viết phương trình hóa học của phản ứng? Tính nồng độ CM của axit clohidric cần dùng? Tính khối lượng kim loại kẽm cần dùng ? Nếu dùng 8,9 gam hỗn hợp gồm kim loại kẽm và magie để điều chế thể tích khí hiddro nói trên thì khối lượng mỗi kim loại là bao nhiêu ? Biết: Mg = 24, Zn = 65, Đề 2 Câu 1: ( 1,5 đ) Thế nào là dung dịch bão hòa, dung dịch chưa bão hòa. độ tan là gì ? Câu 2: ( 1.0 đ) a. Gọi tên các chất có công thức hóa học sau: FeO, HCl b.Viết công thức hóa học của các chất có tên gọi sau đây:Mangan(II)hidroxit;Đồng(II) sunfat. Câu 3: ( 3.0 đ)Lập các PTHH của các phản ứng có sơ đồ sau: a. KMnO4 ? + ? b. K2O + ? KOH c. HgO + H2 ? + ? d. ? + H2SO4 CaSO4 + H2 e. Lưu huỳnh tri oxit + Nước Axit sun furric f. Kim loại magie + Khí oxi Magie oxit Câu 4: (4.5 đ) Thả một mẩu sắt vào 200 ml dung dịch axit clohidric, phản ứng xảy ra hoàn toàn thu được muối săt (II) clorua và 4,48 lit khí hidro (đktc) a. Nêu hiện tượng xãy ra, viết phương trình hóa học của phản ứng? b. Tính nồng độ CM của axit clohidric cần dùng? c. Tính khối lượng kim loại sắt cần dùng ? d. Nếu dùng 8 gam hỗn hợp gồm kim loại sắt và magie để điều chế thể tích khí hiddro nói trên thì khối lượng mỗi kim loại là bao nhiêu ? Biết: Mg = 24, Fe = 56, ĐÁP ÁN-BIỂU ĐIỂM CHẤM BÀI KIỂM TRA HỌC KÌ II - MÔN HÓA 8 Đề 1 Câu Đáp án Điểm 1 (1.5đ) Mỗi ý đúng 0,25 đ - Dung môi là chất có khả năng hoà tan chất khác để tạo thành dung dịch. - Chất tan là chất bị hoà tan trong dung môi - Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan. Vd : - Dung dịch nước muối - Dung môi: nước. -Chất tan: muối. 0.25 0.25 0.25 0.25 0.25 0.25 2 (1.0đ) Mỗi trường hợp đúng 0,25 đ a. Sắt(III)oxit AxitNitric b. Cu(OH)2 FeSO4 0.25 0.25 0.25 0,25 3 (3.0đ) Mỗi PTHH đúng 0,5 đ a. 2KClO3 2KCl + 3O3 b. Na2O + H2O 2NaOH c. PbO + H2 Pb + H2O d. Mg + H2SO4 MgSO4 + H2 e. SO2 + H2O H2SO3 f. 4Al + 3O2 2Al2O3 0,5 0,5 0,5 0,5 0,5 0,5 4 (4.5đ) n H2 = = 0,2 (mol) a. Khi cho kẽm vào dung dịch axit Clohidric có hiện tượng sủi bọt khí, kẽm tan dần PTHH: Zn + 2 HCl -> ZnCl2 + H2 Theo PTHH: 1 mol 2 mol 1 mol Theo bài ra: 0,2 mol 0,4 mol 0,2 mol b. CM HCl = . 1000 = 2 (mol/l) c. m Zn = 0,2 . 65 = 13 (gam) d. Gọi x là số mol H2 tạo ra khi Mg phản ứng ( 0< x < 0,2) Số mol H2 tạo ra khi Zn phản ứng là 0,2 - x PTHH của Mg phản ứng: Mg + HCl -> MgCl2 + H2 Theo PTHH: 1 mol 1 mol Theo bài: x mol x mol Vậy m Mg = 24 x PTHH của Zn phản ứng: Zn + 2 HCl -> ZnCl2 + H2 Theo PTHH: 1 mol 1 mol Theo bài: 0,2 -x mol 0,2 - x mol Vậy m Zn = (0,2 - x). 65 = 13 - 65x Tổng khối lượng của 2 kim loại là: 24x + 13- 65x = 8,9 x = 0,1 Vậy m Mg = 24 . 0,1 = 2,4 (g) m Zn = 8,9 g - 2,4 g = 6,5 g 0,25 0,5 0,5 0,25 0,5 0,25 0,25 0,125 0,125 0,25 0,125 0,125 0,125 0,25 0,125 0,125 0,125 0,125 0,125 0,125 0,125 Đề 2 Câu Đáp án Điểm 1 (1.5đ) Mỗi ý đúng 0,5 đ -Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan ở một ở một nhiệt độ xác định -Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan ở một ở một nhiệt độ xác định -Độ tan của một chất trong nước là số gam chất tan có trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định 0.5 0.5 0.5 2 (1.0đ) Mỗi trường hợp đúng 0,25 đ a. Sắt(II)oxit Axit Clohidric b. Mn(OH)2 CuSO4 0.25 0.25 0.25 0,25 3 (3.0đ) Mỗi PTHH đúng 0,5 đ a. 2 KMnO4 K2MnO4 + MnO2 + O2 b. K2O + H2O 2KOH c. HgO + H2 Hg + H2O d. Ca + H2SO4 CaSO4 + H2 e. SO3 + H2O H2SO4 f. 2Mg + O2 2 MgO 0,5 0,5 0,5 0,5 0,5 0,5 4 (4.5đ) n H2 = = 0,2 (mol) a. Khi cho Sắt vào dung dịch axit Clohidric có hiện tượng sủi bọt khí, sắt tan dần PTHH: Fe + 2 HCl -> FeCl2 + H2 Theo PTHH: 1 mol 2 mol 1 mol Theo bài ra: 0,2 mol 0,4 mol 0,2 mol b. CM HCl = . 1000 = 2 (mol/l) c. m Fe = 0,2 . 56 = 11,2 (g) d. Gọi x là số mol H2 tạo ra khi Mg phản ứng ( 0< x < 0,2) Số mol H2 tạo ra khi Fe phản ứng là 0,2 - x PTHH của Mg phản ứng: Mg + HCl -> MgCl2 + H2 Theo PTHH: 1 mol 1 mol Theo bài: x mol x mol Vậy m Mg = 24 x PTHH của Zn phản ứng: Fe + 2 HCl -> ZnCl2 + H2 Theo PTHH: 1 mol 1 mol Theo bài: 0,2 -x mol 0,2 - x mol Vậy m Zn = (0,2 - x). 56 = 11,2 - 56x Tổng khối lượng của 2 kim loại là: 24x + 11,2- 56x = 8 x = 0,1 Vậy m Mg = 24 . 0,1 = 2,4 (g) m Zn = 8 g - 2,4 g = 5,6 g 0,25 0,5 0,5 0,25 0,5 0,25 0,25 0,125 0,125 0,25 0,125 0,125 0,125 0,25 0,125 0,125 0,125 0,125 0,125 0,125 0,125 Hải Trạch, ngày 9 tháng 4 năm 2012 Gv soạn đáp án Lê Thị Hoài
Tài liệu đính kèm:
 DE_KTHK_II_HOA_8.doc
DE_KTHK_II_HOA_8.doc





