Kiểm tra chất lượng học kỳ I môn: Hóa học 8 Trường THCS Đinh Tiên Hoàng
Bạn đang xem tài liệu "Kiểm tra chất lượng học kỳ I môn: Hóa học 8 Trường THCS Đinh Tiên Hoàng", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
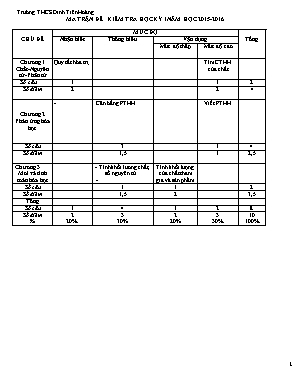
Trường THCS Đinh Tiên Hoàng MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I NĂM HỌC 2015-2016 CHỦ ĐỀ MỨC ĐỘ Tổng Nhận biết Thông hiểu Vận dụng Mức độ thấp Mức độ cao Chương 1 Chất-Nguyên tử-Phân tử Quy tắc hóa trị . Tìm CTHH của chất Số câu 1 1 2 Số điểm 2 2 4 Chương 2 Phản ứng hóa học - Cân bằng PTHH Viết PTHH Số câu 3 1 4 Số điểm 1,5 1 2,5 Chương 3 Mol và tính toán hóa học - Tính khối lương chất, số nguyên tử . - Tính khối lượng của chất tham gia và sản phẩm Số câu 1 1 2 Số điểm 1,5 2 3,5 Tổng Số câu 1 4 1 2 8 Số điểm % 2 20% 3 30% 2 20% 3 30% 10 100% Trường THCS Đinh Tiên Hoàng Họ và tên: . KIỂM TRA CHẤT LƯỢNG HỌC KỲ I Lớp 8A1 MÔN: HÓA HỌC 8 Thời gian: 45’ Điểm: Lời nhận xét của Cô giáo Câu 1: (2đ) Nêu quy tắc hóa trị của hợp chất hai nguyên tố? Cho 2 ví dụ minh họa. Câu 2: (1,5đ) a. 11,5 g Na là bao nhiêu mol? Là khối lượng của bao nhiêu nguyên tử Na? b. Phải lấy bao nhiêu gam Fe để có số nguyên tử đúng bằng số nguyên tử Na? Câu 3: (1,5đ) Cân bằng các phương trình phản ứng sau : a. Fe3O4 + CO t0→ Fe + CO2 b. KClO3 t0→ KCl + O2 c. NH3 + O2 t0→ NO + H2O Câu 4: (3đ) Cho 19,5g kẽm vào axit sunfuric H2SO4 loãng ,dư thu được bao nhiêu lít khí hidro (đktc) và bao nhiêu gam muối kẽm sunfat tạo thành ? Nếu thay thế kẽm bằng nhôm, thì muốn có thể tích H2 (đktc) gấp đôi sẽ cần bao nhiêu gam nhôm? Câu 5 : (2đ) Cho khí hidro tác dụng với 3 gam một loại oxit sắt( chưa rõ hóa trị ) ở nhiệt độ cao,tạo ra 2,1 gam Fe và nước.Tìm công thức phân tử của oxit sắt đó . ( Cho biết Zn = 65; S = 32 ; O= 16; Fe = 56; Al =27 ) Bài làm: ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM MÔN HÓA HỌC 8A1 KIỂM TRA HỌC KÌ I NĂM HỌC 2015-2016 Câu Đáp án Điểm 1 -ĐLBTKL: Trong một công thức hóa học tích của chỉ số và hóa trị nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia. VD: NH3 1 x III = 3 x I . CO2 1 x IV = II x2 1 1 2 nNa=0,5 mol. Số nguyên tử của Na là 3.1023 Số nguyên tử Fe = Số nguyên tử Na = 3.1023 nFe = 3.1023 : 6.1023 = 0,5 mol . mFe = 28g 0,75đ 0,25 đ 0,5đ 3 Cân bằng các phương trình phản ứng : a. Fe3O4 + 4CO t0→ 3Fe + 4CO2 b. 2KClO3 t0→ 2KCl + 3O2 c. 4NH3 + 5O2 t0→ 4NO + 6H2O 0,5đ 0,5đ 0,5đ 4 n Zn = 0,3 mol. PTHH: Zn + H2SO4 → ZnSO4 + H2 nH2 = nZn = n ZnSO4 =0,3 mol → VH2 = 0,3 x 22,4 = 6,72 l m ZnSO4 =0,3 x161= 48,3g b.Thay Zn bằng Al : 2Al+ 3H2SO4 → Al2(SO4 )3 + 3H2 Số mol H2 = 0,6 mol . mAl = 0,6 x 27 = 16,2 g 0,25 đ 0,5 0,25đ 0,5 đ 0,5đ 0,5đ 0,5đ 5 Đặt CTPT của oxit sắt là : FexOy . Phương trình phản ứng : FexOy + yH2 t0 → xFe +yH2O (56x+16y)g 56x(g) 3g 2,1 g Theo PT phản ứng ta có 33,6y = 50,4x . Suy ra : = x=2 ; y = 3. Vậy CTHH Fe2O3 0,25đ 0,75đ 0,5 đ 0,5đ Lưu ý: -HS có cách trình bày khác nhưng kết quả đúng vẫn cho điểm tối đa.
Tài liệu đính kèm:
 KIEM_TRA_KY_1.doc
KIEM_TRA_KY_1.doc





