Kiểm tra 1 tiết (tiết 59) môn: Hoá học 8
Bạn đang xem tài liệu "Kiểm tra 1 tiết (tiết 59) môn: Hoá học 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
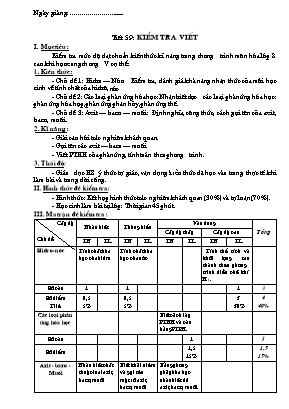
Ngµy gi¶ng: ............................... TiÕt 59: KiÓm tra viÕt I. Môc tiªu: KiÓm tra møc ®é ®¹t chuÈn kiÕn thøc kÜ n¨ng trong ch¬ng tr×nh m«n hãa líp 8 sau khi häc xong ch¬ng V cô thÓ: 1. KiÕn thøc: - Chñ ®Ò 1: Hi®ro – Níc: KiÓm tra, ®¸nh gi¸ kh¶ n¨ng nhËn thøc cña mçi häc sinh vÒ tÝnh chÊt cña hi®r«, níc - Chñ ®Ò 2: C¸c lo¹i ph¶n øng hãa häc: NhËn biÕt ®îc c¸c lo¹i ph¶n øng hãa häc: ph¶n øng hãa hîp, ph¶n øng ph©n hñy, ph¶n øng thÕ. - Chñ ®Ò 3: Axit – baz¬ – muèi: §Þnh nghÜa, c«ng thøc, c¸ch gäi tªn cña axit, baz¬, muèi. 2. KÜ n¨ng: - Gi¶i c©u hái tr¾c nghiÖm kh¸ch quan. - Gäi tªn c¸c axit – bazo – muèi - ViÕt PTHH cña ph¶n øng, tÝnh to¸n theo ph¬ng tr×nh. 3. Th¸i ®é: - Gi¸o dôc HS ý thøc tù gi¸c, vËn dông kiến thøc ®· häc vµo trong thùc tÕ khi lµm bµi vµ trong ®êi sèng . II. H×nh thøc ®Ò kiÓm tra: - H×nh thøc: KÕt hîp h×nh thøc tr¾c nghiªm kh¸ch quan (30%) vµ tù luËn (70%). - Häc sinh lµm bµi t¹i líp: Thêi gian 45 phót. III. Ma trËn ®Ò kiÓm tra: CÊp ®é Chñ ®Ò NhËn biÕt Th«ng hiÓu VËn dông Tæng CÊp ®é thÊp CÊp ®é cao TN TL TN TL TN TL TN TL Hi®ro -níc TÝnh chÊt hãa häc cña hi®ro TÝnh chÊt hãa häc cña níc TÝnh thÓ tÝch vµ khèi lîng t¹o thµnh theo ph¬ng tr×nh ®iÒu chÕ khÝ H2. Sè c©u 1 1 1 3 Sè ®iÓm TØ lÖ 0,5 5% 0,5 5% 3 30% 4 40% C¸c lo¹i ph¶n øng hãa häc BiÕt c¸ch lËp PTHH vµ c©n b»ng PTPH. Sè c©u 1 1 Sè ®iÓm 1,5 15% 1,5 15% Axit - baz¬ - Muèi NhËn biÕt chÊt thuéc lo¹i axit, baz¬, muèi BiÕt kh¸i niÖm vµ gäi tªn mét sè axit, baz¬, muèi B»ng ph¬ng ph¸p hãa häc nhËn biÕt dd axit, baz¬, muèi. Sè c©u 3 1 1 1 6 Sè ®iÓm TØ lÖ 1,5 15% 0,5 5% 1,5 15% 1 10% 4,5 45% Tæng 4 C©u 2 ®iÓm 20% 3 C©u 2,5 ®iÓm 25% 2 C©u 2,5 ®iÓm 25% 1 C©u 3 ®iÓm 30% 10 C©u 10 ® 100% IV. Néi dung ®Ò kiÓm tra: ®Ò bµi A. Tr¾c nghiÖm kh¸ch quan: (3 ®iÓm) Khoanh trßn vµo ®¸p ¸n ®øng tríc c©u tr¶ lêi ®óng: C©u 1: Trong c¸c nhãm chÊt sau. Nhãm chÊt nµo gåm c¸c chÊt lµ axit: A. KMnO4, H2CO3, NaOH C. H2SO4 , HCl, HNO3 B. KClO3, HCl, NaCl D. HCl , CaCO3, H2SO4 C©u 2: §Ó thu khÝ hi®ro trong phßng thÝ nghiÖm b»ng c¸ch ®Èy níc ng êi ta dùa vµo tÝnh chÊt nµo cña khÝ Hi®ro: A. NhÑ h¬n kh«ng khÝ. C. Kh«ng t¸c dông víi kh«ng khÝ. B. Kh«ng t¸c dông víi n íc. D. NhÑ h¬n kh«ng khÝ vµ Ýt tan trong n íc. C©u 3: Cho c¸c chÊt sau chÊt nµo kh«ng t¸c dông ®îc víi níc: A. Cu B. CaO C. K D.SO3 C©u 4: ChÊt lµm qu× tÝm chuyÓn mµu xanh lµ: A. oxit B. axit C. baz¬ D. muèi Câu 5: Công thức Bazơ tương ứng của CaO là: A. CaOH B. Ca(OH)2 C. Ca(OH)3 D. Ca(OH)4 C©u 6: Chän côm tõ: “Mét nguyªn tö kim lo¹i; mét hay nhiÒu nhãm hi®roxit (-OH) ®iÒn vµo chç trèng ®Ó hoµn thiÖn kh¸i niÖm sau: Ph©n tö Baz¬ gåm cã............................................liªn kÕt víi............................. B. Tù luËn: Câu 7: (1,5 ®iÓm): Hoàn thành các phương trình phản ứng sau: a. H2 + ...... H2O b. Fe + ....... FeCl2 + H2 C©u 8: (1 ®iÓm): H·y nªu ph¬ng ph¸p nhËn biÕt 3 dung dÞch ®ùng trong 3 lä mÊt nh·n sau: NaOH; dd HCl; dd Na2SO4. C©u 9: (1,5 ®iÓm): H·y cho biÕt c¸c chÊt sau: H2SO4; NaOH; ZnCl2; thuéc lo¹i hîp chÊt nµo vµ gäi tªn chóng. C©u 10: (3 ®iÓm): Cho 3,5 gam Zn t¸c dông víi dung dÞch HCl d . a. ViÕt ph ¬ng tr×nh ph¶n øng ho¸ häc x¶y ra. b. TÝnh thÓ tÝch khÝ H2 thu ® îc (ë ®ktc) sau ph¶n øng. c. TÝnh khèi l îng muèi ZnCl2 thu ® îc sau ph¶n øng. ( Cho biÕt Zn = 65; H = 1; Cl = 35,5 ; O = 16) V. Híng dÉn chÊm - Thang ®iÓm: A. Tr¾c nghiÖm kh¸ch quan: (3 ®iÓm). Khoanh trßn vµo ®¸p ¸n ®øng tríc c©u tr¶ lêi ®óng: Mçi c©u ®óng 0,5® x 5 = 2,5 ®iÓm C©u 1 2 3 4 5 6 §¸p ¸n C D A C B B B. Tù luËn: (7 ®iÓm) C©u Néi dung §iÓm 7 Hoàn thành các phương trình phản:(X¸c ®Þnh dóng chÊt tham gia p) a. 2H2 + O2 2H2O b. Fe + 2HCl FeCl2 + H2 0,5 0,5 0,5 8 - TrÝch mÉu thö vµ ®¸nh dÊu èng nghiÖm - Nhóng giÊy quú tÝm vµo 3 mÉu thö trong 3 èng nghiÖm: + Dung dÞch trong èng nghiÖm nµo lµm quú tÝm chuyÓn thµnh mµu xanh NaOH. + Dung dÞch trong èng nghiÖm nµo lµm cho quú tÝm chuyÓn thµnh mµu ®á th× dung dÞch ®ã lµ HCl. + Cßn l¹i lµ Na2SO4. 0,25 0,25 0,25 0,25 9 H2SO4 : thuéc lo¹i axit – Tªn gäi: Axit sunfuric NaOH : Thuéc lo¹i baz¬ – Tªn gäi Natrihidroxit ZnCl2 : Thuéc lo¹i muèi – Tªn gäi KÏm clorua 0,5 0,5 0,5 10 a. Ph ¬ng tr×nh ph¶n øng Zn + 2HCl ZnCl2 + H2 b. TÝnh thÓ tÝch khÝ (®ktc) thu ® îc sau ph¶n øng. nZn = = 0,05 mol Theo PTHH sè mol cña Zn b»ng sè mol cña H2 = 0,05 mol Suy ra thÓ tÝch khÝ H2 thu ® îc lµ: 22,4 x 0,05 = 1,12 lÝt. c. TÝnh khèi l îng muèi thu ® îc sau ph¶n øng Theo PTHH th× sè mol ZnCl2 b»ng sè mol Zn = 0, 05 mol VËy khèi l îng cña ZnCl2 thu ® îc lµ: 0,05 x 136 = 6,8 gam 0,5 1,5 1 3. Thu bµi - Gv thu bµi vµ nhËn xÐt ®¸nh gi¸ giê kiÓm tra. 4. Híng dÉn vÒ nhµ. - ¤n tËp l¹i kiÕn thøc lý thuyÕt vµ bµi tËp ®· häc. - Xem tríc néi dung ch¬ng VI: Dung dÞch Họ và tên:.............................. Thứ......ngày.......tháng 4 năm 2014 Lớp: 8....... KIỂM TRA 1 TIẾT (tiết 59) Môn: Hoá học 8. Thời gian: 45’ Điểm Lời phê của GV A. Tr¾c nghiÖm kh¸ch quan: (3 ®iÓm) Khoanh trßn vµo ®¸p ¸n ®øng tríc c©u tr¶ lêi ®óng: C©u 1: Trong c¸c nhãm chÊt sau. Nhãm chÊt nµo gåm c¸c chÊt lµ axit: A. KMnO4, H2CO3, NaOH C. H2SO4 , HCl, HNO3 B. KClO3, HCl, NaCl D. HCl , CaCO3, H2SO4 C©u 2:Chất nào dưới đây có thể dùng để điều chế được hiđrô khi cho tác dụng với dung dịch HCl A.Cu B.Ag C.H2O D.Zn C©u 3: Cho c¸c chÊt sau chÊt nµo kh«ng t¸c dông ®îc víi níc: A. Cu B. CaO C. K D.SO3 C©u 4: ChÊt lµm qu× tÝm chuyÓn mµu xanh lµ: A. oxit B. axit C. baz¬ D. muèi Câu 5: Công thức Bazơ tương ứng của CaO là: A. CaOH B. Ca(OH)2 C. Ca(OH)3 D. Ca(OH)4 C©u 6: Khí X có tỷ khối với H2 là 8,5g.X là khí nào cho dưới đây: A.SO2 B.NH3 C.O2 D.Cl2 B. Tù luËn: Câu 7: (1,5 ®iÓm): Hoàn thành các phương trình phản ứng sau: a. H2 + ...... H2O b. Fe + ....... FeCl2 + H2 C©u 8: (1 ®iÓm): H·y nªu ph¬ng ph¸p nhËn biÕt 3 dung dÞch ®ùng trong 3 lä mÊt nh·n sau: NaOH; dd HCl; dd Na2SO4. C©u 9: (1,5 ®iÓm): H·y cho biÕt c¸c chÊt sau: H2SO4; NaOH; ZnCl2; thuéc lo¹i hîp chÊt nµo vµ gäi tªn chóng. C©u 10: (3 ®iÓm): Cho 3,5 gam Zn t¸c dông víi dung dÞch HCl d . a. ViÕt ph ¬ng tr×nh ph¶n øng ho¸ häc x¶y ra. b. TÝnh thÓ tÝch khÝ H2 thu ® îc (ë ®ktc) sau ph¶n øng. c. TÝnh khèi l îng muèi ZnCl2 thu ® îc sau ph¶n øng. ( Cho biÕt Zn = 65; H = 1; Cl = 35,5 ; O = 16) BÀI LÀM . ........................................................................................................................................................................................................................................................................................... .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. Họ và tên:.............................. Thứ......ngày.......tháng 4 năm 2014 Lớp: 8....... KIỂM TRA 1 TIẾT (tiết 59) Môn: Hoá học 8. Thời gian: 45’ Điểm Lời phê của GV A. Tr¾c nghiÖm kh¸ch quan: (3 ®iÓm) Khoanh trßn vµo ®¸p ¸n ®øng tríc c©u tr¶ lêi ®óng: Câu 1.Axit là chất làm cho quỳ tím chuyển sang màu: A.Xanh B.Đỏ C.Tím D.Không xác định Câu 2.Chất nào dưới đây có thể dùng để điều chế được hiđrô khi cho tác dụng với dung dịch HCl A.Cu B.Ag C.H2O D.Zn C©u 3: Cho c¸c chÊt sau chÊt nµo kh«ng t¸c dông ®îc víi níc: A. Cu B. CaO C. K D.SO3 C©u 4: ChÊt lµm qu× tÝm chuyÓn mµu xanh lµ: A. oxit B. axit C. baz¬ D. muèi Câu 5: Công thức Bazơ tương ứng của CaO là: A. CaOH B. Ca(OH)2 C. Ca(OH)3 D. Ca(OH)4 Câu 5.Dãy chất nào tác dụng với nước: A.SO3,CaO,P2O5 C.Al2O3,SO3,CaO B.Na2O,CuO,P2O5 D.CuO,Al2O3,Na2O B. Tù luËn: Câu 1.(2 điểm) Hoàn thành các phương trình phản ứng sau: a. P + .----> P2O5 b. Al + HCl ----> c. .. + ----> MgO d. Na + H2O ----> +. C©u 2: (2 ®iÓm): H·y cho biÕt c¸c chÊt sau: H2SO4; NaOH; ZnCl2; BaSO4 thuéc lo¹i hîp chÊt nµo vµ gäi tªn chóng. C©u 3: (3 ®iÓm): Cho 3,5 gam Zn t¸c dông víi dung dÞch HCl d . a. ViÕt ph ¬ng tr×nh ph¶n øng ho¸ häc x¶y ra. b. TÝnh thÓ tÝch khÝ H2 thu ® îc (ë ®ktc) sau ph¶n øng. c. TÝnh khèi l îng muèi ZnCl2 thu ® îc sau ph¶n øng. ( Cho biÕt Zn = 65; H = 1; Cl = 35,5 ; O = 16) BÀI LÀM
Tài liệu đính kèm:
 kiem_tra_hoa_8_tiet_59.doc
kiem_tra_hoa_8_tiet_59.doc





