Hóa hữu cơ - Đại cương về hidrocacbon thơm
Bạn đang xem tài liệu "Hóa hữu cơ - Đại cương về hidrocacbon thơm", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
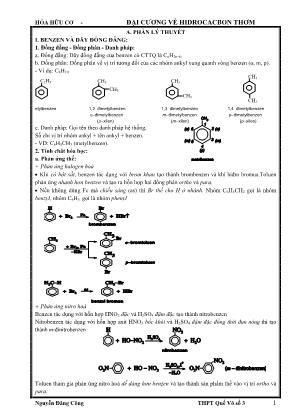
HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 1 A. PHẦN LÝ THUYẾT I. BENZEN VÀ DÃY ĐỒNG ĐẴNG: 1. Đồng đẵng - Đồng phân - Danh pháp: a. Đồng đẵng: Dãy đồng đẵng của benzen có CTTQ là CnH2n-6. b. Đồng phân: Đồng phân về vị trí tương đối của các nhóm ankyl xung quanh vòng benzen (o, m, p). - Ví dụ: C8H10 etylbenzen 1,2®imetylbenzen 1,3®imetylbenzen 1,4®imetylbenzen o®imetylbenzen m®imetylbenzen p®imetylbenzen (oxilen) (mxilen) (pxilen) c. Danh pháp: Gọi tên theo danh pháp hệ thống. Số chỉ vị trí nhóm ankyl + tên ankyl + benzen. - VD: C6H5CH3 (metylbenzen). 2. Tính chât hóa học: a. Phản ứng thế: + Phản ứng halogen hoá Khi có bột sắt, benzen tác dụng với brom khan tạo thành brombenzen và khí hiđro bromua.Toluen phản ứng nhanh hơn benzen và tạo ra hỗn hợp hai đồng phân ortho và para. Nếu không dùng Fe mà chiếu sáng (as) thì Br thế cho H ở nhánh. Nhóm C6H5CH2 gọi là nhóm benzyl, nhóm C6H5 gọi là nhóm phenyl + Phản ứng nitro hoá Benzen tác dụng với hỗn hợp HNO3 đặc và H2SO4 đậm đặc tạo thành nitrobenzen Nitrobenzen tác dụng với hỗn hợp axit HNO3 bốc khói và H2SO4 đậm đặc đồng thời đun nóng thì tạo thành m-đinitrobenzen Toluen tham gia phản ứng nitro hoá dễ dàng hơn benzen và tạo thành sản phẩm thế vào vị trí ortho và para: C2H5 CH3 CH3 CH3 CH3 CH3 CH3 HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 2 - Quy tắc thế H ở vòng benzen: Khi ở vòng benzen đã có sẵn nhóm ankyl (hay các nhóm –OH, -NH2, -OCH3 ), phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí ortho và para. Ngược lại, nếu ở vòng benzen đã có sẵn nhóm –NO2 (hoặc các nhóm -COOH,-SO3H ) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta. - Cơ chế phản ứng thế ở vòng benzen: Phân tử halogen hoặc phân tử axit nitric không trực tiếp tấn công. Các tiểu phân mang điện tích dương tạo thành do tác dụng của chúng với xúc tác mới là tác nhân tấn công trực tiếp vào vòng benzen. Thí dụ : b. Phản ứng cộng: Benzen và ankylbenzen không làm mất màu dung dịch brom (không cộng với brom) như các hiđrocacbon không no. Khi chiếu sáng, benzen cộng với clo thành C6H6Cl6. Khi đun nóng, có xúc tác Ni hoặc Pt, benzen và ankylbenzen cộng với hiđro tạo thành xicloankan, thí dụ : oNi, t 6 6 2 6 12C H 3H C H c. Phản ứng oxi hóa: + Oxi hóa không hoàn toàn Benzen không tác dụng với KMnO4 (không làm mất màu dung dịch KMnO4). Các ankylbenzen khi đun nóng với dung dịch KMnO4 thì chỉ có nhóm ankyl bị oxi hoá. Thí dụ : Toluen bị KMnO4 oxi hoá thành kali benzoat, sau đó tiếp tục cho tác dụng với axit clohiđric thì thu được axit benzoic. Phản ứng này dùng để nhận biết Toluen.benzen C6H5CH3 4 2 0 KMnO , H O 80-100 C 6 5 || C H C OK O HCl 6 5 || C H C OH O C6H5CH2-CH2-R +4KMnO4+ 5H2SO4→ 6 5 || C H C OK O + RCOOK + + + + Oxi hóa hoàn toàn: Các aren khi cháy trong không khí thường tạo ra nhiều muội than. Khi aren cháy hoàn toàn thì tạo ra CO2, H2O và toả nhiều nhiệt. Thí dụ : C6H6 + 15 2 O2 6 CO2 + 3 H2O ; H = -3273kJ CnH2n-6 + 3n -3 2 O2 → nCO2 + (n-3)H2O Nhận xét chung : Benzen tương đối dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và bền vững với các chất oxi hoá. Đó cũng là tính chất hoá học đặc trưng chung của các hiđrocacbon thơm nên được gọi là tính thơm. (58%) (42%) 2 4 2 H SO 2 H O HO NO HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 3 3. Điều chế: a. Điều chế benzen: 3C2H2 CC o600, caotxt o, + 3H2 n- Hecxan caotxt o, 4H2 b. Điều chế ankylbenzen C6H6 + CH2=CH2 H C6H5CH2CH3 C6H6 + CH3− CH2=CH2 H C6H5C(CH3)2 4. Ứng dung - Sản xuất dược phẩm, thuốc nhuộm - Làm dung môi II. STIREN: 1. Cấu tạo: CTPT: C8H8; CTCT: 2. Tính chất hóa học: a. Phản ứng cộng: Br2, HCl... ( với dung dịch Br2. Phản ứng này dùng để nhận biết stiren.) 6 5 2 2 6 5 2 || C H CH CH Br C H CH CH BrBr 6 5 2 6 5 3 | C H CH CH HCl C H CH CH Cl b. Phản ứng với H2. (Giống benzen và anken) c. Tham gia phản ứng trùng hợp ở liên kết đôi C=C . oxt, t 2 2 2 2 2 | | | | | 5 5 5 5 56 6 6 6 6 nCH CH ... CH CH CH CH CH CH CH CH C H C H C H C H C H ... 2 | n56 CH CH C H polistiren Phản ứng trùng hợp đồng thời 2 hay nhiều loại monome gọi là phản ứng đồng trùng hợp. Thí dụ : oxt, t 2 2 2 2 2 2 | | 6 5 6 5 nCH CH CH CH n CH CH ... CH CH CH CH CH CH ... C H C H 2 2 2 | 56 CH CH CH CH CH CH C H n poli(buta®ien-stiren) d. Phản ứng oxi hoá : Giống như etilen, stiren làm mất màu dung dịch KMnO4 và bị oxi hoá ở nhóm vinyl, còn vòng benzen vẫn giữ nguyên. CH=CH2 Halogen (Cl2, Br2), hiđro halogenua (HCl, HBr) cộng vào nhóm vinyl ở stiren tương tự như cộng vào anken. HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 4 III. NAPTTALEN: 1. Câu tạo phân tử: - CTPT: C10H8. CTCT: 2. Tính chất hóa học: a. Tham gia phản ứng thế: Naphtalen tham gia các phản ứng thế dễ hơn so với benzen. Sản phẩm thế vào vị trí 1 (vị trí ) là sản phẩm chính b. Tham gia phản ứng cộng. c. Phản ứng oxit hóa Naphtalen không bị oxi hoá bởi dung dịch KMnO4. Khi có xúc tác V2O5 ở nhiệt độ cao nó bị oxi hoá bởi oxi không khí tạo thành anhiđrit phtalic. IV. CUMEN (Isopropybenzen) 1. Điều chế: C6H6 + CH3−CH2=CH3 H C6H5−CH(CH3)2 2. Tính chất: C6H5−CH(CH3)2 .522 ,,1 OVO C6H5−OH + CO(CH3)2 HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 5 B. PHƢƠNG PHÁP GIẢI MỘT SỐ DẠNG BÀI TẬP HIĐROCACBON THƠM I. Dạng 1. Phả n ứng thế (phả n ứ ng clo hóa, brom hóa, nitro hóa) Phương pháp giải: Nhữ ng lưu ý khi làm các bài tậ p liên quan đến phả n ứng thế của iđrocacbon thơm : + Phản ứng clo hóa, brom hóa (to, Fe) hoặc phản ứng nitro hóa (to, H2SO4 đặc) đối với hiđrocacbon thơm phả i tuân theo quy tắ c thế trên vòng benzen. + Phản ứng clo hóa, brom hóa có thể xảy ra ở phần mạch nhánh no của vòng benzen khi điều kiện phản ứng là ánh sáng khuế ch tán và đun nóng (đối với brom). + Trong bài toán liên quan đến phả n ứng nitro hóa thì sản phẩm thu đượ thường là hỗn hợp các chấ t, vì vậy ta nên sử dụ ng phương pháp trung bình để tính toán. Ví dụ 1: Lượng clobenzen thu được khi cho 15,6 gam C6H6 tác dụng hết với Cl2 (xúc tác bột Fe) với hiệu suất phản ứng đạt 80% là : A. 14 gam. B. 16 gam. C. 18 gam. D. 20 gam. Hƣớng dẫn giải: nC6H6 pư= 16,08,0. 78 6,15 mol Phương trình phản ứng : C6H6 + Cl2 Feto , C6H5Cl + HCl (1) mol: 0,16 0,16 Vậy khối lượng clobenzen thu được là : 0,16.112,5= 18 gam => Đáp án C Ví dụ 2: Hỗn hợp gồm 1 mol C6H6 và 1,5 mol Cl2. Trong điều kiện có xúc tác bột Fe, t o, hiệu suất 100%. Sau phản ứng thu được chất gì ? bao nhiêu mol ? A. 1 mol C6H5Cl ; 1 mol HCl ; 1 mol C6H4Cl2 B. 1,5 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2 C. 1 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2 D. 0,5 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2 Hướng dẫn giả i 2 1 5,1 1 66 2 HC Cl n n => phản ứng tạo ra hỗn hợp hai sản phẩm là C6H5Cl và C6H4Cl2 PTHH: HClClHCClHC Feto 56266 mol x x x x HClClHCClHC Feto 222 56266 mol y y 2y 2y x=0,5, y=0,5 => đáp án D Ví dụ 3: Một hợp chất hữu cơ X có vòng benzen có CTĐGN là C3H2Br và M = 236. Gọi tên hợp chất này biết rằng hợp chất này là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe). A. o- hoặc p-đibrombenzen. B. o- hoặc p-đibromuabenzen. C. m-đibromuabenzen. D. m-đibrombenzen. Hƣớng dẫn giải Đặt CTPT của hợp chất X là (C3H2Br)n suy ra (12.3+2+80).n = 236 => n = 2. Do đó công thức phân tử của X là C6H4Br2. Vì hợp chất X là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe) nên theo quy tắc thế trên vòng benzen ta thấy X có thể là o- đibrombenzen hoặc p-đibrombenzen Ví dụ 4: Hiđrocacbon X là đồng đẳng của benzen có phần trăm khối lượng cacbon bằng 90,56%. Biết khi X tác dụng với brom có hoặc không có mặt bột sắt trong mỗi trường hợp chỉ thu ược một dẫn xuất monobrom duy nhất. Tên của X là : A. Toluen. B. 1,3,5-trimetyl benzen. C. 1,4-imetylbenzen. D. 1,2,5-trimetyl benzen. Hƣớng dẫ n giải Đặt công thức phân tử của X là CnH2n-6 (n > 6) Theo bài : 100 56,90 614 12 n n => n=8 Vậy X có công thức phân tử là C8H12 Vì X tác dụng với brom có hoặc không có mặt bột sắt trong mỗi trường hợp chỉ thu được một dẫn xuất monobrom duy nhất nên tên của X là: 1,4-đimetylbenzen HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 6 Ví dụ 5: Đốt cháy hoàn toàn a gam hiđrocacbon X thu được a gam H2O. Trong phân tử X có vòng benzen. X không tác dụng với brom khi có mặt bột Fe, còn khi tác dụng với brom đun nóng tạo thành dẫn xuất chứa 1 nguyên tử brom duy nhất. Tỉ khối hơi của X so với không khí có giá trị trong khoảng từ 5 đến 6. X là: A. Hexan. B. Hexametyl benzen. C. Toluen. D. Hex-2-en Hướng dẫn giải Đặt CTPT của X là CxHy PTHH: OH y xCOO y xHC ot yx 222 2 ) 4 ( mol 1 2 y mo yx a 12 18 a x:y=2;3 => CTĐGN của X là : C2H3 => CTPT (C2H3)n Vì tỉ khối hơi của X so với không khí có giá trị trong khoảng từ 5 đến 6 nên ta có : 29.5 5,3 n = 6 => công thức phân tử của X là C12H18 Trong phân tử X có vòng benzen. X không tác dụng với brom khi có mặt bột Fe, còn khi tác dụng với brom đun nóng tạo thành dẫn xuất chứa 1 nguyên tử brom duy nhất nên tên của X là : Hecxametyl benzen Ví dụ 6: TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen là: A. 550,0 gam. B. 687,5 gam. C. 454,0 gam. D. 567,5 gam Hƣớng dẫ n giả i Phương trình phản ứng : C6H5CH3 + 3HNO3 dSOHto 42, C6H2(NO2)3CH3 + 3H2O gam 92 227 gam 230.80% x => x= 454,0 gam Đáp án C Ví dụ 7: Nitro hóa benzen được 14,1 gam hỗn hợp hai chất nitro có khối lượng phân tử hơn kém nhau 45 đvC. Đốt cháy hoàn toàn hỗn hợp hai chất nitro này được 0,07 mol N2. Hai chất nitro đó là: A. C6H5NO2 và C6H4(NO2)2. B. C6H4(NO2)2 và C6H3(NO2)3. C. C6H3(NO2)3 và C6H2(NO2)4. D. C6H2(NO2)4 và C6H(NO2)5 Hướng dẫn giải Đặt công thức phân tử trung bình của hai hợp chất nitro là: nn NOHC )( 266 Ta có nn NOHC )( 266 222 , 22 6 62 N n OH n CO otO mol 1 2 n mol n4578 1,14 0,07 => n =1,4 Theo giả thiết hỗn hợp hai chất nitro có khối lượng phân tử hơn kém nhau 45 đvC nên phân tử của chúng hơn kém nhau một nhóm -NO2. Căn cứ vào giá trị số nhóm –NO2 trung bình là 1,4 ta suy ra hai hợp chất nitro có công thức là C6H5NO2 và C6H4(NO2)2. Đáp án A Ví dụ 8: Nitro hoá bezen thu được hỗn hợp 2 chất hữu cơ X và Y, trong đó Y nhiều hơn X một nhóm –NO2. Đốt cháy hoàn toàn 12,75 gam hỗn hợp X, Y thu được CO2, H2O và 1,232 lít N2 (đktc). Công thức phân tử và số mol X trong hỗn hợp là : A. C6H5NO2 và 0,9. B. C6H5NO2 và 0,09. HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 7 C. C6H4(NO2)2 và 0,1. D. C6H5NO2 và 0,19. Hƣớng dẫn giải: Đặt công thức phân tử trung bình của hai hợp chất nitro là: nn NOHC )( 266 Ta có nn NOHC )( 266 222 , 22 6 62 N n OH n CO otO mol 1 2 n mol n4578 1,14 0,055 => n =1,1 Theo giả thiết hỗn hợp hai chất nitro có khối lượng phân tử hơn kém nhau 45 đvC nên phân tử của chúng hơn kém nhau một nhóm -NO2. Căn cứ vào giá trị số nhóm –NO2 trung bình là 1,1 ta suy ra hai hợp chất nitro có công thức là C6H5NO2 và C6H4(NO2)2 Tổng số mol của hỗn hợp X và Y là 0,1 mol Áp dụng sơ đồ đường chéo : số mol C6H4NO2 là 0,09 Đáp án B II. Dạng 2. Phản ứng trùng hợp Ví dụ 10: Tiến hành trùng hợp 10,4 gam stiren được hỗn hợp X gồm polistiren và stiren (dư). Cho X tác dụng với 200 ml dung dịch Br2 0,15M, sau đó cho dung KI dư vào thấy xuất hiện 1,27 gam iot. Hiệu suất trùng hợp stiren là : A. 60%. B. 75%. C. 80%. D. 83,33%. Hƣớng dẫn giải: Đáp án B HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 8 III. Dạng 3. Phản ứng oxi hóa Phƣơng pháp giải Ví dụ 12: Để oxi hoá hết 10,6 gam o-xylen (1,2-đimetylbenzen) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng. Giả sử dùng dư 20% so với lượng phản ứng. A. 0,48 lít. B. 0,24 lít. C. 0,12 lít. D. 0,576 lít Hƣớng dẫn giải: Ví dụ 13: Đốt cháy hết m gam 2 đồng đẳng của benzen A, B thu được 4,05 gam H2O và 7,728 lít CO2 (đktc). Giá trị của m và số tổng số mol của A, B là : A. 4,59 và 0,04. B. 9,18 và 0,08. C. 4,59 và 0,08. D. 9,14 và 0,04 Hƣớng dẫn giải: Ví dụ 14: Đốt cháy hết 9,18 gam 2 đồng đẳng của benzen A, B thu được 8,1 gam H2O và V lít CO2(đktc). Giá trị của V là : A. 15,654. B. 15,465. C. 15,546. D. 15,456 Hƣớng dẫn giải: HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 9 Đáp án D Ví dụ 15: Đốt cháy hết 9,18 gam 2 đồng đẳng kế tiếp thuộc dãy của benzen A, B thu được H2O và 30,36 gam CO2. Công thức phân tử của A và B lần lượt là : A. C6H6 ; C7H8. B. C8H10 ; C9H12. C. C7H8 ; C9H12. D. C9H12 ; C10H14 Hƣớng dẫn giải: Đáp án B Ví dụ 16: Đốt cháy hoàn toàn một thể tích hơi hợp chất hữu cơ A cần 10 thể tích oxi (đo cùng điều kiệnnhiệt độ và áp suất), sản phẩm thu được chỉ gồm CO2 và H2O với m CO 2 : m H2O = 44 : 9. Biết MA < 150. A có công thức phân tử là : A. C4H6O. B. C8H8O. C. C8H8. D. C2H2 Hƣớng dẫn giải: Ví dụ 17: Đốt cháy hoàn toàn hiđrocacbon X cho CO2 và H2O theo tỉ lệ mol 1,75 : 1 về thể tích. Cho bay hơi hoàn toàn 5,06 gam X thu được một thể tích hơi đúng bằng thể tích của 1,76 gam oxi trong cùng điều kiện. Nhận xét nào sau đây là đúng đối với X ? A. X không làm mất màu dung dịch Br2 nhưng làm mất màu dung dịch KMnO4 đun nóng. B. X tác dụng với dung dịch Br2 tạo kết tủa trắng. C. X có thể trùng hợp thành PS. D. X tan tốt trong nước. HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 10 Hƣớng dẫn giải: Ví dụ 18: A, B, C là ba chất hữu cơ có %C, %H (theo khối lượng) lần lượt là 92,3% và 7,7%, tỉ lệ khối lượng mol tương ứng là 1: 2 : 3. Từ A có thể điều chế B hoặc C bằng một phản ứng. C không làm mất màu nước brom. Đốt 0,1 mol B rồi dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vôi trong dư. a. Khối lượng bình tăng hoặc giảm bao nhiêu gam ? A. Tăng 21,2 gam. B. Tăng 40 gam. C. Giảm 18,8 gam. D. Giảm 21,2 gam. b. Khối lượng dung dịch tăng hoặc giảm bao nhiêu gam ? A. Tăng 21,2 gam. B. tăng 40 gam. C. giảm 18,8 gam. D. giảm 21,2 gam Hƣớng dẫn giải: HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 11 C. BÀI TẬP HIĐROCACBON THƠM Câu 1: Trong phân tử benzen, các nguyên tử C đều ở trạng thái lai hoá : A. sp. B. sp 2 . C. sp 3 . D. sp 2 d Câu 2: Trong vòng benzen mỗi nguyên tử C dùng 1 obitan p chưa tham gia lai hoá để tạo ra : A. 2 liên kết pi riêng lẻ. B. 2 liên kết pi riêng lẻ. C. 1 hệ liên kết pi chung cho 6 C. D. 1 hệ liên kết xigma chung cho 6 C. Câu 3: Trong phân tử benzen: A. 6 nguyên tử H và 6 C đều nằm trên 1 mặt phẳng. B. 6 nguyên tử H nằm trên cùng 1 mặt phẳng khác với mặt phẳng của 6 C. C. Chỉ có 6 C nằm trong cùng 1 mặt phẳng. D. Chỉ có 6 H mằm trong cùng 1 mặt phẳng. Câu 4: Cho các công thức : (1) H (2) (3) Cấu tạo nào là của benzen ? A. (1) và (2). B. (1) và (3). C. (2) và (3). D. (1) ; (2) và (3). Câu 5: Dãy đồng đẳng của benzen có công thức chung là: A. CnH2n+6 ; n 6. B. CnH2n-6 ; n 3. C. CnH2n-6 ; n 6. D. CnH2n-6 ; n 6. Câu 6: Công thức tổng quát của hiđrocacbon CnH2n+2-2a. Đối với stiren, giá trị của n và a lần lượt là: A. 8 và 5. B. 5 và 8. C. 8 và 4. D. 4 và 8. Câu 7: Công thức tổng quát của hiđrocacbon CnH2n+2-2a. Đối với naptalen, giá trị của n và a lần lượt là: A. 10 và 5. B. 10 và 6. C. 10 và 7. D. 10 và 8. Câu 8: Chất nào sau đây có thể chứa vòng benzen ? A. C10H16. B. C9H14BrCl. C. C8H6Cl2. D. C7H12. Câu 9: Chất nào sau đây không thể chứa vòng benzen ? A. C8H10. B. C6H8. C. C8H10. D. C9H12. Câu 10: Cho các chất: C6H5CH3 (1) p-CH3C6H4C2H5 (2) C6H5C2H3 (3) o-CH3C6H4CH3 (4) Dãy gồm các chất là đồng đẳng của benzen là: A. (1); (2) và (3). B. (2); (3) và (4). C. (1); (3) và (4). D. (1); (2) và (4). Câu 11: Chât cấu tạo như sau có tên gọi là gì ? CH3 CH3 A. o-xilen. B. m-xilen. C. p-xilen. D. 1,5- đimetylbenzen. Câu 12: CH3C6H2C2H5 có tên gọi là: A. etylmetylbenzen. B. metyletylbenzen. C. p-etylmetylbenzen. D. p- metyletylbenzen. Câu 13: (CH3)2CHC6H5 có tên gọi là: A. propylbenzen. B. n-propylbenzen. C. iso-propylbenzen. D. đimetylbenzen. Câu 14: iso-propyl benzen còn gọi là: A.Toluen. B. Stiren. C. Cumen. D. Xilen. Câu 15: Cấu tạo của 4-cloetylbenzen là: A. C2H5 Cl B. C2H5 Cl C. C2H5 Cl D. C2H5 Cl Câu 16: Ankylbenzen là hiđrocacbon có chứa : A. vòng benzen. B. gốc ankyl và vòng benzen. C. gốc ankyl và 1 benzen. D. gốc ankyl và 1 vòng benzen. HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 12 Câu 17: Gốc C6H5-CH2- và gốc C6H5- có tên gọi là: A. phenyl và benzyl. B. vinyl và anlyl. C. anlyl và Vinyl. D. benzyl và phenyl. Câu 18: Điều nào sau đâu không đúng khí nói về 2 vị trí trên 1 vòng benzen ? A. vị trí 1, 2 gọi là ortho. B. vị trí 1,4 gọi là para. C. vị trí 1,3 gọi là meta. D. vị trí 1,5 gọi là ortho. Câu 19: Một ankylbenzen A có công thức C9H12, cấu tạo có tính đối xứng cao. Vậy A là: A. 1,2,3-trimetyl benzen. B. n-propyl benzen. C. iso-propyl benzen. D. 1,3,5-trimetyl benzen. Câu 20: Một ankylbenzen A (C12H18) cấu tạo có tính đối xứng cao. A là: A. 1,3,5-trietylbenzen. B. 1,2,4-tri etylbenzen. C. 1,2,3-tri metylbenzen. D. 1,2,3,4,5,6-hexaetylbenzen. Câu 21: C7H8 có số đồng phân thơm là: A. 1. B. 2. C. 3. D. 4. Câu 22: Ứng với công thức phân tử C8H10 có bao nhiêu cấu tạo chứa vòng benzen ? A. 2. B. 3. C. 4. D. 5. Câu 23: Ứng với công thức C9H12 có bao nhiêu đồng phân có cấu tạo chứa vòng benzen ? A. 6. B. 7. C. 8. D. 9. Câu 24: Số lượng đồng phân chứa vòng benzen ứng với công thức phân tử C9H10 là A. 7. B. 8. C. 9. D. 6. Câu 25: A là đồng đẳng của benzen có công thức nguyên là: (C3H4)n. Công thức phân tử của A là: A. C3H4. B. C6H8. C. C9H12. D. C12H16. Câu 26: Cho các chất (1) benzen ; (2) toluen; (3) xiclohexan; (4) hex-5-trien; (5) xilen; (6) cumen. Dãy gồm các hiđrocacbon thơm là: A. (1); (2); (3); (4). B. (1); (2); (5; (6). C. (2); (3); (5) ; (6). D. (1); (5); (6); (4). Câu 27: Hoạt tính sinh học của benzen, toluen là: A. Gây hại cho sức khỏe. B. Không gây hại cho sức khỏe. C. Gây ảnh hưởng tốt cho sức khỏe. D. Tùy thuộc vào nhiệt độ có thể gây hại hoặc không gây hại. Câu 28: Tính chất nào sau đây không phải của ankyl benzen A. Không màu sắc. B. Không mùi vị. C. Không tan trong nước. D. Tan nhiều trong các dung môi hữu cơ. Câu 29: Phản ứng nào sau đây không xảy ra: A. Benzen + Cl2 (as). B. Benzen + H2 (Ni, p, t o ). C. Benzen + Br2 (dd). D. Benzen + HNO3 (đ) /H2SO4 (đ). Câu 30: Tính chất nào không phải của benzen ? A. Dễ thế. B. Khó cộng. C. Bền với chất oxi hóa. D. Kém bền với các chất oxi hóa. Câu 31: Cho benzen + Cl2 (as) ta thu được dẫn xuất clo A. Vậy A là: A. C6H5Cl. B. p-C6H4Cl2. C. C6H6Cl6. D. m-C6H4Cl2. Câu 32: Phản ứng chứng minh tính chất no; không no của benzen lần lượt là: A. thế, cộng. B. cộng, nitro hoá. C. cháy, cộng. D. cộng, brom hoá. Câu 33: Tính chất nào không phải của benzen A. Tác dụng với Br2 (t o , Fe). B. Tác dụng với HNO3 (đ) /H2SO4(đ). C. Tác dụng với dung dịch KMnO4. D. Tác dụng với Cl2 (as). Câu 34: Benzen + X etyl benzen. Vậy X là A. axetilen. B. etilen. C. etyl clorua. D. etan. Câu 35: Tính chất nào không phải của toluen ? A. Tác dụng với Br2 (t o , Fe). B. Tác dụng với Cl2 (as). C. Tác dụng với dung dịch KMnO4, t o . D. Tác dụng với dung dịch Br2. Câu 36: So với benzen, toluen + dung dịch HNO3(đ)/H2SO4 (đ): A. Dễ hơn, tạo ra o – nitro toluen và p – nitro toluen. B. Khó hơn, tạo ra o – nitro toluen và p – nitro toluen. C. Dễ hơn, tạo ra o – nitro toluen và m – nitro toluen. D. Dễ hơn, tạo ra m – nitro toluen và p – nitro toluen. Câu 37: Toluen + Cl2 (as) xảy ra phản ứng: HÓA HỮU CƠ - ĐẠI CƢƠNG VỀ HIDROCACBON THƠM Nguyễn Đăng Công THPT Quế Võ số 3 13 A. Cộng vào vòng benzen. B. Thế vào vòng benzen, dễ dàng hơn. C. Thế ở nhánh, khó khăn hơn CH4. D. Thế ở nhánh, dễ dàng hơn CH4. Câu 38: 1 mol Toluen + 1 mol Cl2 asA . A là: A. C6H5CH2Cl. B. p-ClC6H4CH3. C. o-ClC6H4CH3. D. B và C đều đúng. Câu 39: Tiến hành thí nghiệm cho nitro benzen tác dụng với HNO3 (đ)/H2SO4 (đ), nóng ta thấy: A. Không có phản ứng xảy ra. B. Phản ứng dễ hơn benzen, ưu tiên vị trí meta. C. Phản ứng khó hơn benzen, ưu tiên vị trí meta. D. Phản ứng khó hơn benzen, ưu tiên vị trí ortho. Câu 40: Khi trên vòng benzen có sẵn nhóm thế -X, thì nhóm thứ hai sẽ ưu tiên thế vào vị trí o- và p- . Vậy -X là những nhóm thế nào ? A. -CnH2n+1, -OH, -NH2. B. -OCH3, -NH2, -NO2. C. -CH3, -NH2, -COOH. D. -NO2, -COOH, - SO3H. Câu 41: Khi trên vòng benzen có sẵn nhóm thế -X, thì nhóm thứ hai sẽ ưu tiên thế vào vị trí m - . Vậy -X là những nhóm thế nào ? A. -CnH2n+1, -OH, -NH2. B. -OCH3, -NH2, -NO2. C. -CH3, -NH2, -COOH. D. -NO2, -COOH, - SO3H. Câu 42: 1 mol nitrobenzen + 1 mol HNO3 đ 2 4o H SO d t B + H2O. B là: A. m-đinitrobenzen. B. o-đinitrobenzen. C. p-đinitrobenzen. D. B và C đều đúng. Câu 43: C2H2 A B m-brombenzen. A và B lần lượt là: A. benzen ; nitrobenzen. B. benzen,brombenzen. C. nitrobenzen ; benzen. D. nitrobenzen; brombenzen. Câu 44: Benzen A o-brom-nitrobenzen. Công thức của A là: A. nitrobenzen. B. brombenzen. C. aminobenzen. D. o-đibrombenzen. Câu 45: 1 ankylbenzen A(C9H12),tác dụng với HNO3 đặc (H2SO4 đ) theo tỉ lệ mol 1:1 tạo ra 1 dẫn xuất mononitro duy nhất . Vậy A là: A. n-propylbenzen. B. p-etyl,metylbenzen. D. iso-propylbenzen D. 1,3,5-trimetylbenzen. Câu 46: Cho phản ứng A /trung hop 1,3,5-trimetylbenzen . A là: A. axetilen. B. metyl axetilen. C. etyl axetilen. D. đimetyl axetilen. Câu 47: Stiren không phản ứng được với những chất nào sau đây ? A. dd Br2. B. không khí H2 ,Ni,t o . C. dd KMnO4. D. dd NaOH. Câu 48: A + 4H2 , , oNi p t etyl xiclohexan. Cấu tạo của A là: A. C6H5CH2CH3. B. C6H5CH3. C. C6H5CH2CH=CH2. D. C6H5CH=CH2. Câu 49: Phản ứng nào sau đây không dùng để điều chế benzen ? A. tam hợp axetilen. B. khử H2 của xiclohexan. C. khử H2, đóng vòng n-hexan. D. tam hợp etilen. Câu 50: Phản ứng nào không điều chế được toluen ? A. C6H6 + CH3Cl 3 ; oAlCl t B. khử H2, đóng vòng benzen C. khử H2 metylxiclohexan D. tam hợp propin
Tài liệu đính kèm:
 Benzen_va_dong_dang_on_thi_THPT_Quoc_gia_2016.pdf
Benzen_va_dong_dang_on_thi_THPT_Quoc_gia_2016.pdf





