Đề thi thử tốt nghiệp THPT lần 1 năm 2021-2022 môn Hóa Học - ĐHQG TPHCM Phổ thông Năng Khiếu
Bạn đang xem tài liệu "Đề thi thử tốt nghiệp THPT lần 1 năm 2021-2022 môn Hóa Học - ĐHQG TPHCM Phổ thông Năng Khiếu", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
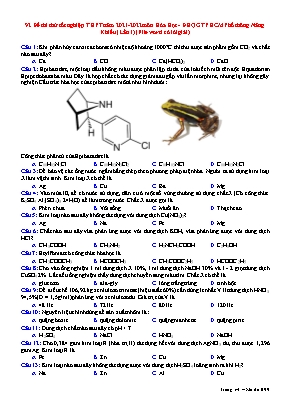
92 Đề thi thử tốt nghiệp THPT năm 2021-2022 môn Hóa Học - ĐHQG TPHCM Phổ thông Năng Khiếu (Lần 1) (File word có lời giải) Câu 1: Khi phân hủy canxi cacbonat ở nhiệt độ khoảng 1000°C thì thu được sản phẩm gồm CO2 và chất nào sau đây? A. Ca. B. CO. C. Ca(HCO3)2. D. CaO. Câu 2: Epibatidine, một loại dầu không màu được phân lập từ da của loài ếch mũi tên độc Equadorian Epipedobates ba màu. Đây là hợp chất có tác dụng giảm đau gấp vài lần morphine, nhưng lại không gây nghiện. Cấu trúc hóa học của epibatidine mô tả như hình dưới: Công thức phân tử của Epibatadine là A. C11H13N3Cl. B. C11H13N3Cl2. C. C11H13NCl. D. C11H13N2Cl. Câu 3: Để bảo vệ các ống nước ngầm bằng thép theo phương pháp điện hóa. Người ta sử dụng kim loại X làm vật hi sinh. Kim loại X có thể là A. Ag. B. Cu. C. Ba. D. Mg. Câu 4: Vào mùa lũ, để có nước sử dụng, dân cư ở một số vùng thường sử dụng chất X (Có công thức K2SO4.Al2(SO4)3.24H2O) để làm trong nước. Chất X được gọi là A. Phèn chua. B. Vôi sống. C. Muối ăn. D. Thạch cao. Câu 5: Kim loại nào sau đây không tác dụng với dung dịch Cu(NO3)2? A. Ag. B. Na. C. Fe. D. Mg. Câu 6: Chất nào sau đây vừa phản ứng được với dung dịch KOH, vừa phản ứng được với dung dịch HCl? A. CH3COOH. B. CH3NH2. C. H2NCH2COOH. D. C2H5OH. Câu 7: Etyl fomat có công thức hóa học là A. CH3COOCH3. B. HCOOCH3. C. CH3COOC2H5. D. HCOOC2H5. Câu 8: Cho vào ống nghiệm 1 ml dung dịch X 10%, 1 ml dung dịch NaOH 30% và 1 - 2 giọt dung dịch CuSO4 2%. Lắc đều ống nghiệm thấy dung dịch chuyển sang màu tím. Chất X có thể là A. glucozơ. B. ala-gly. C. lòng trắng trứng. D. tinh bột. Câu 9: Để điều chế 106,92 kg xenlulozơ trinitrat (hiệu suất 60%) cần dùng ít nhất V lít dung dịch HNO3 94,5% (D = 1,5 g/ml) phản ứng với xenlulozơ dư. Giá trị của V là A. 48 lít. B. 72 lít. C. 80 lít. D. 120 lít. Câu 10: Nguyên liệu chính dùng để sản xuất nhôm là: A. quặng boxit. B. quặng dolomit. C. quặng manhetit. D. quặng pirit. Câu 11: Dung dịch chất nào sau đây có pH > 7 A. H2SO4. B. NaCl. C. HNO3. D. NaOH. Câu 12: Cho 0,384 gam kim loại R (hóa trị II) tác dụng hết với dung dịch AgNO3 dư, thu được 1,296 gam Ag. Kim loại R là A. Fe. B. Zn. C. Cu. D. Mg. Câu 13: Kim loại nào sau đây không tác dụng được với dung dịch H2SO4 loãng sinh ra khí H2? A. Na. B. Zn. C. Al. D. Cu. Câu 14: Chất X là một loại monosaccarit có nhiều trong mật ong, có vị ngọt sắc. Công thức phân tử của chất X có thể là A. C2H4O2. B. C6H12O6. C. C12H22O11. D. (C6H10O5)n. Câu 15: Cho dãy các chất: vinyl clorua, etilen, buta-1,3-đien, glyxin, etylen glicol. Số chất trong dãy có khả năng tham gia phản ứng trùng ngưng tạo polime là A. 1. B. 3. C. 4. D. 2. Câu 16: Dung dịch của chất X làm quỳ tím hóa đỏ, dung dịch của chất Y làm quỳ tím hóa xanh. Trộn lẫn dung dịch của hai chất, thì xuất hiện kết tủa. Vậy X và Y có thể lần lượt là A. NaHSO4 và Ba(OH)2. B. H2SO4 và NaOH. C. HCl và Na2CO3. D. Na2CO3 và Ba(OH)2. Câu 17: X là kim loại phản ứng được với dung dịch H2SO4 loãng,Y là kim loại tác dụng được với dung dịch HNO3 đặc nguội. Hai kim loại X, Y lần lượt là A. Cu, Fe. B. Ag, Zn. C. Mg, Ag. D. Fe, Al. Câu 18: Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ quan sát được hiện tượng nào sau đây? A. Có kết tủa trắng. B. Không có hiện tượng gì. C. Có bọt khí thoát ra. D. Có kết tủa trắng và bọt khí thoát ra. Câu 19: Sắt có số oxi hóa +2 trong hợp chất nào sau đây? A. Fe2(SO4)3. B. Fe(NO3)3. C. Fe(OH)3. D. FeSO4. Câu 20: Natri clorua được dùng để làm gia vị thức ăn, điều chế natri, xút, nước Gia-ven. Công thức của natri clorua là A. NaHCO3. B. Na2CO3. C. NaCl. D. KCl. Câu 21: Kim loại nào sau đây được lựa chọn làm vật liệu dẫn điện cao thế vì độ dẫn điện tốt và nhẹ? A. Fe. B. K. C. Al. D. Ag. Câu 22: Trong các kim loại sau đây: Ag, Mg, Fe và Al. Kim loại có tính khử yếu nhất là A. Al. B. Fe. C. Mg. D. Ag. Câu 23: Chất nào sau đây có thể tham gia phản ứng tráng bạc? A. HCOOC2H3. B. CH3COOCH3. C. C2H5COOH. D. CH3COOH. Câu 24: Natri hiđrocacbonat được dùng làm thuốc giảm đau dạ dày do thừa axit. Công thức của natri hiđrocacbonat là A. Na2CO3. B. NaHCO3. C. K2CO3. D. KHCO3. Câu 25: Nước cứng là nước chứa nhiều ion A. Na+ và Ag+. B. Ca2+ và Mg2+. C. Fe2+ và K+. D. Na+ và Al3+. Câu 26: Công thức nào sau đây có thể là công thức của chất béo? A. (C17H35COO)3C3H5. B. (C2H5COO)3C3H5. C. (CH3COO)3C3H5. D. (C17H35COO)2C2H4. Câu 27: Cho E, Z, F, T đều là các hợp chất hữu cơ no, mạch hở và thỏa mãn sơ đồ các phản ứng: (1) E + NaOH → X + Y + Z (2) X + HCl → F + NaCl (3) Y + HCl → T + NaCl Biết E chỉ chứa nhóm chức este và trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi; (113 < ME < 225); MZ < MF < MT. Cho các phát biểu sau: (a) Chất F được dùng để điều chế khí CO trong phòng thí nghiệm. (b) 1 mol chất T phản ứng với kim loại Na dư, thu được tối đa 1 mol H2. (c) Nhiệt độ sôi của Z cao hơn nhiệt độ sôi của C2H5OH. (d) Có hai công thức cấu tạo của E thỏa mãn sơ đồ trên. (e) Trong phân từ Z và F đều không có liên kết pi. (g) T là hợp chất đa chức. Số phát biểu đúng là A. 2. B. 3. C. 1. D. 4. Câu 28: Hỗn hợp E gồm ba este no, mạch hở X, Y và Z, trong đó có một este hai chức và hai este đơn chức, MX < MY < MZ. Đốt cháy hết 32,24 gam E cần vừa đủ 1,41 mol O2, thu được H2O và 1,3 mol CO2. Mặt khác, thủy phân hoàn toàn 32,24 gam E trong dung dịch NaOH vừa đủ, thu được 40,9 gam hỗn hợp F gồm ba muối khan; và 0,27 mol hỗn hợp T gồm hai ancol kế tiếp nhau trong dãy đồng đẳng. Phần trăm khối lượng của muối có phân tử khối lớn nhất trong F có giá trị gần nhất với A. 46. B. 43. C. 13. D. 10. Câu 29: Hòa tan hết m gam hỗn hợp X gồm MgO, CuO và Fe2O3 bằng dung dịch HCl, thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch NaOH dư, thu được (m + 5,4) gam kết tủa. Biết trong X, nguyên tố oxi chiếm 25% khối lượng. Giá trị của m là A. 9.6. B. 12,8. C. 24,0. D. 19,2. Câu 30: Nung hỗn hợp T gồm 2,43 gam Al và m gam Fe3O4 ở nhiệt độ cao trong điều kiện không có oxi. Sau một thời gian, làm nguội thu được hỗn hợp rắn X gồm Al, Fe, Al2O3, FeO và Fe3O4. Cho toàn bộ X phản ứng với dung dịch HCl dư, thu được 2,352 lít H2 và dung dịch Y. Cô cạn Y được 27,965 gam hỗn hợp muối khan. Giá trị của m là A. 9,28. B. 9,71. C. 7,87. D. 4,64. Câu 31: Cho các thí nghiệm sau: (a) Cho a mol bột Fe vào dung dịch chứa a mol AgNO3 và a mol Fe(NO3)3. (b) Cho a mol khí CO2 vào dung dịch chứa 1,5a mol KOH. (c) Cho a mol Fe(OH)2 vào dung dịch chứa a mol H2SO4 loãng. (d) Cho dung dịch chứa a mol KOH vào dung dịch chứa a mol Ca(HCO3)2. (e) Cho 2a mol P2O5 vào dung dịch chứa 3a mol NaOH. Số thí nghiệm thu được dung dịch chứa hai chất tan sau khi các phản ứng xảy ra hoàn toàn là A. 1. B. 3. C. 4. D. 2. Câu 32: Hỗn hợp khí A gồm H2 và hiđrocacbon X (CnH2n, mạch hở) có tỉ khối so với H2 là 5. Dẫn hỗn hợp khí A qua bột Ni nung nóng, sau một thời gian thu được hỗn hợp khí B (gồm hai hiđrocacbon và H2) có tỉ khối so với heli là 25/9. Biết m gam B phản ứng tối đa với 0,05 mol Br2 trong dung dịch. Mặt khác, đốt cháy hoàn toàn m gam B, thu được 0,3 mol CO2 và 0,7 mol H2O. Trong công thức phân tử, X có số nguyên tử hiđro là A. 8. B. 2. C. 6. D. 4. Câu 33: Hỗn hợp X gồm hai amin no, đơn chức, mạch hở. Hỗn hợp Y gồm Gly, Ala, Val. Trộn a mol X với b mol Y thu được hỗn hợp Z. Đốt cháy Z cần dùng 1,05 mol O2, sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua bình đựng H2SO4 đặc, dư, thấy khối lượng bình tăng 18 gam, đồng thời thu được 17,92 lít hỗn hợp khí. Tỉ a : b là A. 3 : 2. B. 2 : 1. C. 1 : 1. D. 3 : 1. Câu 34: Cho ba dung dịch chứa 3 chất tan tương ứng E, F, G thỏa mãn: + Nếu cho E tác dụng với F thì thu được hỗn hợp kết tủa X. Cho X vào dung dịch HNO3 loãng dư, thấy thoát ra khi không màu hóa nâu ngoài không khí, đồng thời thu được phần không tan Y. + Nếu F tác dụng với G thì thấy khí thoát ra, đồng thời thu được kết tủa. + Nếu E tác dụng G thì thu được kết tủa Z. Cho Z vào dung dịch HCl dư, thấy có khí không màu thoát ra. Các chất E, F và G lần lượt là A. NaHSO4, Ba(HCO3)2, Fe(NO3)3. B. CuSO4, Ba(OH)2, Na2CO3. C. FeCl2, AgNO3, Ba(OH)2. D. FeSO4, Ba(OH)2, (NH4)2CO3. Câu 35: Điện phân dung dịch gồm CuSO4 và NaCl (diện cực trơ, màng ngăn xốp, hiệu suất điện phân là 100%, bỏ qua sự hoà tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi là 9,65A trong thời gian t giây. Sau điện phân thu được 2,24 lít (đktc) hỗn hợp khí X gồm hai khí có tỉ khối so với H2 là 16,39. Kết luận nào sau đây không đúng? A. Dung dịch sau điện phân có pH < 7. B. Giá trị của t là 3960. C. Hai khí trong X là Cl2 và H2. D. Khối lượng dung dịch sau điện phân giảm 15,95 gam so với dung dịch trước khi điện phân. Câu 36: Ứng với công thức phân tử C7H16, có bao nhiêu đồng phân ankan có tên mạch chính là pentan? A. 7. B. 4. C. 6. D. 5. Câu 37: Cho các phát biểu sau: (a) Tất cả các protein đều tan trong nước tạo thành dung dịch keo. (b) Có thể sử dụng dung dịch HCl để rửa các ống nghiệm sau khi thí nghiệm với anilin. (c) Cho triolein vào nước, lắc đều, sau đó thu được dung dịch đồng nhất. (d) Tính bazơ của anilin yếu hơn so với metylamin. (e) Phân tử Glu-Ala-Val có bốn nguyên tử oxi. (f) Thủy phân không hoàn toàn tinh bột, có thể thu được saccarozơ. (g) Để pha rượu uống, có thể dùng metanol pha với nước. Số phát biểu đúng là A. 3. B. 2. C. 5. D. 4. Câu 38: Tiến hành thí nghiệm theo các bước sau: Bước 1: Cho vào ống nghiệm 5 giọt CuSO4 5% và 1ml dung dịch NaOH 10%. Lắc nhẹ, gạn bỏ phần dung dịch và lấy kết tủa cho vào ống nghiệm (1). Bước 2: Lấy 1,5 ml dung dịch saccarozơ 1% vào ống nghiệm (2) và thêm vào đó 0,5 ml dung dịch H2SO4 loãng. Đun nóng dung dịch khoảng 3 phút. Bước 3: Để nguội dung dịch, cho từ từ (và khuấy đều) tinh thể NaHCO3 vào ống nghiệm (2) đến khi khí ngừng thoát ra. Bước 4: Rót dung dịch trong ống nghiệm (2) vào ống nghiệm (1), lắc đều cho đến khi tủa tan hoàn toàn. Cho các phát biểu sau: (a) Trong thí nghiệm trên, ở bước 1, có thể thay dung dịch NaOH bằng dung dịch Ba(OH)2. (b) Sau bước 1, thu được kết tủa có màu đỏ đặc trưng. (c) Ở bước 2 xảy ra phản ứng thủy phân saccarozơ. (d) Sau bước 2, dung dịch có chứa 1 loại monosaccarit. (e) Trong bước 3, cho NaHCO3 vào ống nghiệm (2) để thủy phân hoàn toàn saccarozơ. (f) Sau bước 3, dung dịch trong ống nghiệm (2) có thể cho phản ứng tráng bạc. (g) Sau bước 4, thu được dung dịch có màu xanh lam đặc trưng. Số phát biểu đúng là A. 4. B. 5. C. 2. D. 3. Câu 39: Hoà tan 17,44 gam hỗn hợp X gồm FeS, Cu2S và Fe(NO3)2 (trong đó nguyên tố nitơ chiếm 6,422% khối lượng hỗn hợp) vào dung dịch HNO3 đặc, nóng, dư. Sau các phản ứng thu được hỗn hợp khí Y (gồm NO2 và SO2) và dung dịch Z. Cho dung dịch Ba(OH)2 dư vào Z, sau phản ứng thu được 35,4 gam kết tủa T gồm 3 chất. Lọc tách T rồi nung đến khối lượng không đổi thu được 31,44 gam chất rắn E. Phần trăm khối lượng của nguyên tố oxi trong E gần nhất với giá trị nào sau đây? A. 27,5. B. 24,5. C. 32,5. D. 18,2. Câu 40: Hỗn hợp X gồm triglixerit Y và axit béo Z. Cho m gam X phản ứng hoàn toàn với dung dịch NaOH dư, thu được sản phẩm hữu cơ gồm một muối và 4,6 gam glixerol. Nếu đốt cháy hết m gam X thì cần vừa đủ 4,425 mol O2, thu được 3,21 mol CO2 và 2,77 mol H2O. Khối lượng của Z trong m gam X là A. 8,40 gam. B. 5,60 gam. C. 64 gam. D. 11,20 gam.
Tài liệu đính kèm:
 de_thi_thu_tot_nghiep_thpt_lan_1_nam_2021_2022_mon_hoa_hoc_d.doc
de_thi_thu_tot_nghiep_thpt_lan_1_nam_2021_2022_mon_hoa_hoc_d.doc





