Đề thi tham khảo học kì II năm học 2015 - 2016 môn hóa học 8 thời gian làm bài : 60 phút (không kể thời gian phát đề)
Bạn đang xem tài liệu "Đề thi tham khảo học kì II năm học 2015 - 2016 môn hóa học 8 thời gian làm bài : 60 phút (không kể thời gian phát đề)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
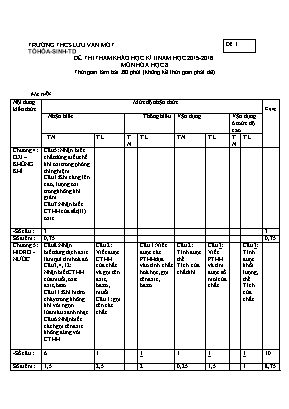
Đề 1 TRƯỜNG THCS LƯU VĂN MÓT TỔ HÓA-SINH-TD ĐỀ THI THAM KHẢO HỌC KÌ II NĂM HỌC 2015-2016 MÔN HÓA HỌC 8 Thời gian làm bài :60 phút (không kể thời gian phát đề) Ma trận Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức độ cao TN TL TN TL TN TL TN TL Chương 4: OXI – KHÔNG KHÍ Câu 5: Nhận biết chất dùng điều chế khí oxi trong phòng thí nghiệm. Câu 1:Khi càng lên cao , lượng oxi trong không khí giảm. Câu 7:Nhận biết CTHH của sắt (II) oxit. -Số câu : 3 3 Số điểm : 0,75 0,75 Chương 5: HIĐRO -NƯỚC Câu 8:Nhận biếtdung dịch axit làm quì tím hoá đỏ Câu3,4,12: Nhận biết CTHH của muối,oxit axit,bazơ Câu11 :Khí hidro cháy trong không khí với ngọn lửa màu xanh nhạt Câu6:Nhận biết cách gọi tên axit không đúng với CTHH Câu 2: Viết được CTHH của chất và gọi tên axit , bazơ , muối Câu 1: gọi tên các chất Câu 1:Viết được các PTHHdựa vào tính chất hoá học, gọi tên axit , bazơ Câu 2: Tính được thể Tích của chất khí Câu 3: Viết PTHH và tìm được số mol của chất Câu 3: Tính được khối lượng, thể Tích của chất -Số câu : 6 1 1 1 1 1 10 Số điểm : 1,5 2,5 2 0,25 1,5 1 8,75 Chương 6: DUNG DỊCH Câu10:Khái niệm dung dịch Câu 9: Tính được nồng độ % của dung dịch: -Số câu : 1 1 2 -Sốđiểm: 0,25 0,25 0,5 TS câu: 10 1 1 2 1 1 15 TS điểm:10 5 2 2 1 10 A/ PHẦN TRẮC NGHIỆM: ( 3 điểm ) Học sinh chọn câu đúng nhất mỗi câu 0,25 điểm Câu 1:Khi càng lên cao , lượng oxi trong không khí : A . Tăng B . Giảm C . Không thay đổi D . Tăng gấp đôi Câu 2 :Cho 0,1 mol Zn tác dụng với dung dịch axit HCl , thì thể tích khí H2 thu được là bao nhiêu ? A. 11,2 lít B. 5,6 lít C . 4,48 lít D . 2,24 Câu 3 : Dãy chất nào gồm toàn loại bazơ ? A. HCl , H2SO4 , H3PO4 B. NaOH , KOH , Ca(OH)2 C. NaCl , CuSO4 , FeCl3 D. KCl , NaOH , HNO3 Câu 4 : Dãy chất nào gồm toàn loại muối ? A. HCl , H2SO4 , ZnCl2 B. NaOH , KCl , Ca(OH)2 C. NaOH , Cu(OH)2 , FeCl3 D. KCl , Na2SO4 , KHSO4 Câu 5. Chất nào được dùngđể điều chế khí oxi trong phòng thí nghiệm ? A. KMnO4 B. H2O C. Không khí D. Fe3O4 Câu 6:Trong các chất sau ,chất nào có tên gọi không đúng với công thức đã ghi ? A. HCl :Axit clohidric B.H2SO3 :Axit sunfuric C. HNO3 :Axit nitric D.H3PO4 :Axit photphoric Câu 7: Công thức của sắt (II) oxit là: A .Fe2O B. Fe3O4 C. FeO D.Fe2O3 Câu 8: Dung dịch axit làm đổi màu quỳ tím thành : A. Trắng B. Xanh C. Vàng D.Đỏ Câu 9 :Hoà tan 10gam NaOH vào 40 gam nước , ta được nồng độ dung dịch NaOH là : A .10 % B . 30% C . 60% D .20% Câu10 : Dung dịch là hỗn hợp : A .Đồng nhất của dung môi và chất tan B .Của chất rắn trong chất lỏng C .Đồng nhất của chất rắn và dung môi D . Của chất khí trong chất lỏng Câu11 :Khí hidro cháy trong không khí với ngọn lửa : A .Không màu B .Màu đỏ C . Màu vàng D. Màu xanh nhạt Câu12. Dãy chất nào gồm toàn loại oxit axit ? A. SO2 , CO2 , P2O5 B .Na2O , CuO , ZnO C. CO2 , SO2 , Na2O D. CO2 , K2O , CuO B/ PHẦN TỰ LUẬN (7 điểm ) Câu 1: (2,5 điểm ) Viết phương trình thực hiện chuyển hóa sau, ghi rõ điều kiện ( nếu có): a ) Ca CaO Ca(OH)2 b) P P2O5 H3PO4 Đọc tên của Ca(OH)2 , H3PO4 Câu2 :(2 điểm ) a ) Viết công thức hóa học của các hợp chất sau : Natri hidroxit, Đồng (II) hidroxit , Natri clorua, Canxiphotphat. b ) Gọi tên các chất sau : HBr , Al(OH)3 , FeCl3 , Na2HPO4 Câu3 :(2,5 điểm ) Cho 6,5 g kẽm vào dung dịch axit clohidric,thu được muối kẽm clorua (ZnCl2) và khí H2 . a . Tính khối lượng muối ZnCl2 tạo thành sau phản ứng ? b .Tính thể tích khí H2 thu được ( ởđktc ) ? ( Biết : Zn = 65 ; H = 1 ; Cl = 35,5 ) - Hết- ĐÁP ÁN A/ PHẦN TRẮC NGHIỆM : (3điểm ) Mỗi câu đúng 0,25 điểm CAU 1 2 3 4 5 6 7 8 9 10 11 12 CHỌN B D B D A B C D D A D A B/ PHẦN TỰ LUẬN :(7 Điểm) Câu 1: (2,5 điểm ) a) 2Ca + O2 t0 2 CaO (0,5điểm) CaO + H2O Ca(OH)2 (0,5điểm) b) 4 P + 5 O2 t0 2P2O5 (0,5điểm) P2O5 + 3 H2O 2 H3PO4 (0,5điểm) *Tên : Ca(OH)2 : Canxihidroxit (0,25 điểm) H3PO4 :Axit photphoric (0,25 điểm) Câu 2: (2 điểm ) a / Viết đúng mỗi CTHH (0,25 điểm) NaOH ; Cu(OH)2 ; NaCl ; Ca3 (PO4 )2 b/ Gọi tên đúng mỗi chất ( 0,25điểm) .HBr : Axit brom hidric Al(OH)3 : Nhôm hidroxit FeCl3 : Sắt (III) clorua Na2HPO4 : Natri hidrophotphat Câu 3 : ( 2,5điểm) Tóm tắt : Biết mZn =6,5 gam Tìm : a/ m ZnCl2 = ? b/ VH2 = ? a) Số mol kẽm: n Zn = 6,5/ 65 = 0,1 (mol ) ( 0,5 đ) PTHH : Zn + 2 HCl à ZnCl2 + H2 (0,5 đ) Theo PT 1 mol 2 mol 1 mol 1 mol Theo ĐB 0,1 mol à 0,2 mol à 0,1 mol à 0,1 mol (0,5 đ) Khối lượng kẽm clorua là: m ZnCl2 = 0,1 x 136 = 13,6 (g) ( 0,5 đ) b) Thể tích khí hidro ở đktc là: VH2 = 0,1 x 22,4 = 2,24 (l) ( 0,5 đ ) ( Học sinh làm cách khác nếu đúng vẫn đạt điểm tương đương ) - Hết-
Tài liệu đính kèm:
 DE THI HKII MÔN HOÁ 8 -1.doc
DE THI HKII MÔN HOÁ 8 -1.doc





