Đề thi học kì II - Hóa – Khối 12
Bạn đang xem tài liệu "Đề thi học kì II - Hóa – Khối 12", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
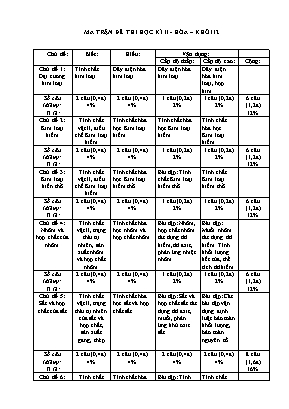
MA TRẬN ĐỀ THI HỌC KÌ II - HÓA – KHỐI 12 Chủ đề: Biết: Hiểu: Vận dụng: Cấp độ thấp: Cấp độ cao: Cộng: Chủ đề 1: Đại cương kim loại Tính chất kim loại Dãy điện hóa kim loại Dãy điện hóa kim loại Dãy điện hóa kim loại, hợp kim Số câu (điểm): Tỉ lệ: 2 câu (0,4đ) 4% 2 câu (0,4đ) 4% 1 câu (0,2đ) 2% 1 câu (0,2đ) 2% 6 câu (1,2đ) 12% Chủ đề 2: Kim loại kiềm Tính chất vật lí, điều chế Kim loại kiềm Tính chất hóa học Kim loại kiềm Tính chất hóa học Kim loại kiềm Tính chất hóa học Kim loại kiềm Số câu (điểm): Tỉ lệ: 2 câu (0,4đ) 4% 2 câu (0,4đ) 4% 1 câu (0,2đ) 2% 1 câu (0,2đ) 2% 6 câu (1,2đ) 12% Chủ đề 3: Kim loại kiền thổ Tính chất vật lí, điều chế Kim loại kiềm Tính chất hóa học Kim loại kiềm thổ Bài tập: Tính chất Kim loại kiềm thổ Tính chất Kim loại kiềm thổ Số câu (điểm): Tỉ lệ: 2 câu (0,4đ) 4% 2 câu (0,4đ) 4% 1 câu (0,2đ) 2% 1 câu (0,2đ) 2% 6 câu (1,2đ) 12% Chủ đề 4: Nhôm và hợp chất của nhôm Tính chất vật lí, trạng thái tự nhiên, sản xuất nhôm và hợp chất nhôm Tính chất hóa học nhôm và hợp chất nhôm Bài tập: Nhôm, hợp chất nhôm tác dụng dd kiềm, dd axit, phản ứng nhiệt nhôm Bài tập: Muối nhôm tác dụng dd kiềm. Tính khối lượng kết tủa, thể tích dd kiềm Số câu (điểm): Tỉ lệ: 2 câu (0,4đ) 4% 2 câu (0,4đ) 4% 1 câu (0,2đ) 2% 1 câu (0,2đ) 2% 6 câu (1,2đ) 12% Chủ đề 5: Sắt và hợp chất của sắt Tính chất vật lí, trạng thái tự nhiên của sắt và hợp chất, sản xuất gang, thép Tính chất hóa học sắt và hợp chất sắt Bài tập: Sắt và hợp chất sắt tác dụng dd axit, muối, phản ứng khử oxit sắt Bài tập: Các bài tập vận dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố Số câu (điểm): Tỉ lệ: 2 câu (0,4đ) 4% 2 câu (0,4đ) 4% 2 câu (0,4đ) 4% 2 câu (0,4đ) 4% 8 câu (1,6đ) 16% Chủ đề 6: Crom và hợp chất của Crom Tính chất vật lí, trạng thái tự nhiên của crom và hợp chất crom Tính chất hóa học crom và hợp chất crom Bài tập: Tính chất hóa học crom và hợp chất Tính chất hóa học crom và hợp chất Số câu (điểm): Tỉ lệ: 2 câu (0,4đ) 4% 2 câu (0,4đ) 4% 1 câu (0,2đ) 2% 1 câu (0,2đ) 2% 6 câu (1,2đ) 12% Chủ đề 7: Nhận biết các chất Nhận biết chất khí Nhận biết các dung dịch Số câu (điểm): Tỉ lệ: 3 câu (0,6đ) 6% 3 câu (0,6đ) 6% Chủ đề 8: Hóa học và vấn đề môi trường Hóa học và vấn đề môi trường Số câu (điểm): Tỉ lệ: 3 câu (0,6đ) 6% 3 câu (0,6đ) 6% Chủ đề 9: Tổng hợp kiến thức Tổng hợp kiến thức Tổng hợp kiến thức Số câu (điểm): Tỉ lệ: 3 câu (0,6đ) 6% 3 câu (0,6đ) 6% 6 câu (1,2đ) 12% Tổng : Số câu (điểm): Tỉ lệ: 15 câu (3đ) 30% 15 câu (3đ) 30% 10 câu (2đ) 20% 10 câu (2đ) 20% 50 câu (10đ) 100% TRUNG TÂM GDTX - HNDN HUYỆN ........ THI HỌC KÌ II – NĂM HỌC 2015 - 2016 Môn: Hóa học – Khối 12 Thời gian làm bài: 90 phút; Mã đề thi 132 Họ và tên học viên:..................................................................... Lớp: ............................. ĐIỂM NHẬN XÉT CỦA GIÁM KHẢO CHỮ KÝ GIÁM KHẢO Ghi chú: - Đề thi gồm có 04 trang. - Học viên khoanh tròn vào câu đúng nhất. - Mỗi câu đúng: 0,2 điểm - Cho biết nguyên tử khối (theo u) của các nguyên tố là: H = 1; C = 12; N = 14; O = 16; Cu = 64; Al = 27; Zn = 65; Fe = 56; Mg = 24; Cr = 52; Mn =55; K = 39; S = 32; Ba = 137; Be = 7; Na = 23; Cl = 35,5; Li = 7, Rb = 85. Câu 1: Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch A. HCl. B. H2SO4. C. NaOH. D. NaNO3. Câu 2: Kim loại nào sau đây có tính dẫn điện tốt nhất trong tất cả các kim loại? A. Bạc. B. Đồng. C. Vàng. D. Nhôm. Câu 3: Hai kim loại đều thuộc nhóm IIA trong bảng tuần hoàn là A. Ca, Ba. B. Sr, K. C. Na, Ba. D. Be, Al. Câu 4: Khi so sánh trong cùng một điều kiện thì Cr là kim loại có tính khử mạnh hơn A. Fe. B. K. C. Na. D. Ca. Câu 5: Cho 0,69 gam một kim loại kiềm tác dụng với nước (dư) thu được 0,336 lít khí hiđro (ở đktc). Kim loại kiềm là A. Rb. B. Na. C. Li. D. K. Câu 6: Cho các phát biểu sau: (1) Các kim loại kiềm đều tác dụng với nước ở nhiệt độ thường. (2) Các kim loại Mg, Na và Al được điều chế bằng phương pháp điện phân nóng chảy. (3) Kim loại Mg và K đều khử được ion Ag+ trong dung dịch thành Ag. (4) Khi cho Mg vào dung dịch FeCl3 dư thu được kim loại Fe. Số phát biểu đúng là A. 3. B. 4. C. 1. D. 2. Câu 7: Công thức chung của oxit kim loại thuộc nhóm IA là A. RO2. B. R2O3. C. R2O. D. RO. Câu 8: Ngâm một lá Fe trong dung dịch CuSO4. Sau một thời gian phản ứng lấy lá Fe ra rửa nhẹ làm khô, đem cân thấy khối lượng tăng thêm 1,6 gam. Khối lượng Cu bám trên lá Fe là bao nhiêu gam? A. 9,6 gam. B. 6,4 gam. C. 12,8 gam. D. 8,2 gam. Câu 9: Nguyên liệu chính dùng để sản xuất nhôm là A. quặng pirit. B. quặng boxit. C. quặng manhetit. D. quặng đôlômit. Câu 10: Cho Fe (Z = 26), cấu hình electron của ion Fe2+ là A. [Ar]3d5. B. [Ar]3d6. C. [Ar]3d3. D. [Ar]3d4. Câu 11: Khử hoàn toàn 16 gam Fe2O3 bằng khí CO ở nhiệt độ cao. Khí đi ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là A. 25 gam. B. 30 gam. C. 20 gam. D. 15 gam Câu 12: Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là A. 3,36 lít. B. 2,24 lít. C. 4,48 lít. D. 6,72 lít. Câu 13: Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm A. Cu, Al, Mg. B. Cu, Al2O3, Mg. C. Cu, Al, MgO. D. Cu, Al2O3, MgO. Câu 14: Cho 1 luồng khí H2 dư lần lượt đi qua các ống mắc nối tiếp đựng các oxit nung nóng như hình vẽ sau: 1 2 3 4 5 CaO CuO Al2O3 Fe2O3 Na2O Ở ống nào có phản ứng xảy ra: A. Ống 1, 2, 3. B. Ống 2, 3, 4. C. Ống 2, 4, 5. D. Ống 2, 4. Câu 15: Khi cho dòng điện một chiều I=2A qua dung dịch CuCl2 trong 10 phút. Biết rằng ở catot chưa xuất hiện bọt khí, khối lượng đồng sinh ra là A. 0,4 gam. B. 40 gam. C. 0,2 gam. D. 4 gam. Câu 16: Kim loại không phản ứng với nước ở nhiệt độ thường là A. Na. B. Ba. C. Be. D. Ca. Câu 17: Al2O3 phản ứng được với cả hai dung dịch: A. NaOH, HCl. B. NaCl, H2SO4. C. Na2SO4, KOH. D. KCl, NaNO3. Câu 18: Nước cứng là nước có chứa nhiều các ion A. Ca2+, Mg2+. B. Cu2+, Fe3+. C. Al3+, Fe3+. D. Na+, K+. Câu 19: Hoà tan 2,52 gam một kim loại bằng dung dịch H2SO4 loãng (dư), cô cạn dung dịch thu được 6,84 gam muối khan. Kim loại đó là: A. Mg. B. Zn. C. Fe. D. Al. Câu 20: Kim loại Al không phản ứng với dung dịch A. H2SO4 loãng. B. H2SO4 đặc, nguội. C. H2SO4 đặc, nóng. D. NaOH loãng. Câu 21: Khối luợng K2Cr2O7 cần dùng để oxi hoá hết 0,6 mol FeSO4 trong dung dịch có H2SO4 loãng làm môi trường là A. 29,6 gam B. 59,2 gam. C. 24,9 gam. D. 29,4 gam Câu 22: Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là A. 2. B. 1,8. C. 1,2. D. 2,4. Câu 23: Oxit lưỡng tính là A. CrO. B. MgO. C. CaO. D. Cr2O3. Câu 24: Cặp chất không xảy ra phản ứng là A. Cu + AgNO3. B. Zn + Fe(NO3)2. C. Fe + Cu(NO3)2. D. Ag + Cu(NO3)2. Câu 25: Dãy gồm hai chất chỉ có tính oxi hoá là A. Fe(NO3)2, FeCl3. B. FeO, Fe2O3. C. Fe(OH)2, FeO. D. Fe2O3, Fe2(SO4)3. Câu 26: Để khử hoàn toàn 30 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4, MgO cần dùng 5,6 lít khí CO (ở đktc). Khối lượng chất rắn sau phản ứng là A. 22 gam. B. 28 gam. C. 26 gam. D. 24 gam. Câu 27: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có A. kết tủa trắng xuất hiện. B. kết tủa trắng, sau đó kết tủa tan dần. C. bọt khí và kết tủa trắng. D. bọt khí bay ra. Câu 28: Cho phản ứng: a Fe + b HNO3 c Fe(NO3)3 + d NO + e H2O Các hệ số a, b, c, d, e là những số nguyên, đơn giản nhất. Thì tổng (a+b) bằng A. 3. B. 6. C. 5. D. 4. Câu 29: Dung dịch làm quỳ tím chuyển sang màu xanh là A. NaCl. B. NaNO3. C. Na2SO4. D. NaOH. Câu 30: Tính chất hóa học đặc trưng của kim loại là A. tính oxi hóa. B. tính khử. C. tính axit. D. tính bazơ. Câu 31: Cho m gam Fe vào dung dịch HNO3 lấy dư ta thu được 8,96 lít (đktc) hỗn hợp khí X gồm NO và NO2 có tỉ khối hơi hỗn hợp X so với oxi bằng 1,3125. Giá trị của m là A. 0,56 gam. B. 1,12 gam. C. 11,2 gam. D. 5,6 gam. Câu 32: Thổi V lít (đktc) khí CO2 vào 300 ml dung dịch Ca(OH)2 0,02M thì thu được 0,2 gam kết tủa. Giá trị của V là: A. 224 ml B. 44,8 ml hoặc 224 ml C. 44,8 ml hoặc 89,6 ml D. 44,8 ml Câu 33: Các số oxi hoá đặc trưng của crom là: A. +2; +4, +6. B. +2, +3, +6. C. +1, +2, +4, +6. D. +3, +4, +6. Câu 34: Khí nào sau có trong không khí đã làm cho các đồ dùng bằng bạc lâu ngày bị xám đen? A. O2. B. CO2. C. H2S. D. SO2. Câu 35: Cho các kim loại: Na, Mg, Fe, Al; kim loại có tính khử mạnh nhất là A. Mg. B. Na. C. Fe. D. Al. Câu 36: Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl (dư) thoát ra V lít khí H2 (ở đktc). Giá trị của V là A. 7,84. B. 4,48. C. 3,36. D. 10,08. Câu 37: Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là A. có kết tủa keo trắng và có khí bay lên. B. có kết tủa keo trắng, sau đó kết tủa tan. C. chỉ có kết tủa keo trắng. D. không có kết tủa, có khí bay lên. Câu 38: Để phân biệt CO2 và SO2 chỉ cần dùng thuốc thử là A. dung dịch Ba(OH)2. B. CaO. C. dung dịch NaOH. D. nước brom. Câu 39: Hiện tượng trái đất nóng lên do hiệu ứng nhà kính chủ yếu là do chất nào sau đây? A. Khí cacbonmonooxit. B. Khí clo. C. Khí hidroclorua. D. Khí cacbonic. Câu 40: Tỉ lệ số người chết về bệnh phổi do hút thuốc lá gấp hàng chục lần số người không hút thuốc là. Chất gây nghiện và gây ung thư có trong thuốc lá là A. nicotin. B. aspirin. C. cafein. D. moocphin. Câu 41: Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IA là A. 3. B. 2. C. 4. D. 1. Câu 42: Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là A. vôi sống. B. cát. C. lưu huỳnh. D. muối ăn. Câu 43: Sắt có thể tan trong dung dịch nào sau đây? A. FeCl3. B. AlCl3. C. MgCl2. D. FeCl2 . Câu 44: Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch K2CrO4 thì màu của dung dịch chuyển từ A. màu vàng sang màu da cam. B. không màu sang màu da cam. C. không màu sang màu vàng. D. màu da cam sang màu vàng. Câu 45: Cho các kim loại: K, Mg, Al, Zn, Fe, Cu. Số kim loại được điều chế bằng phương pháp nhiệt luyện là: A. 5. B. 3. C. 4. D. 2. Câu 46: Sục từ từ CO2 vào V lít dung dịch Ba(OH)2 0,5M, kết quả thí nghiệm biểu diễn trên đồ thị sau : Giá trị của V là A. 0,1. B. 0,05. C. 0,2. D. 0,8. Câu 47: Trong các loại quặng sắt, quặng có hàm lượng sắt cao nhất là A. hematit nâu. B. manhetit. C. xiđerit. D. hematit đỏ. Câu 48: Khi trộn lẫn dung dịch chứa 0,15 mol NaHCO3 với dung dịch chứa 0,10 mol Ba(OH)2, sau phản ứng thu được m gam kết tủa trắng. Giá trị m là A. 34,90 gam. B. 39,40 gam. C. 29,55 gam. D. 19,70 gam. Câu 49: Cấu hình electron của nguyên tử Na (Z =11) là A. 1s22s2 2p6 3s1. B. 1s22s2 2p6 3s2. C. 1s22s2 2p6 3s23p1. D. 1s22s2 2p6. Câu 50: Hỗn hợp X gồm Cu và Fe, trong đó Cu chiếm 43,24% khối lượng. Cho 14,8 gam X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc). Giá trị của V là: A. 1,12 lít. B. 2,24 lít. C. 4,48 lít. D. 3,36 lít. ---------------------HẾT------------------- Thí sinh không được sử dụng tài liệu. Giám thị coi thi không giải thích gì thêm.Họ và tên giám thị:... Chữ ký giám thị: 132 1 C 2 A 3 A 4 A 5 B 6 D 7 C 8 C 9 B 10 B 11 B 12 A 13 D 14 C 15 A 16 C 17 A 18 A 19 C 20 B 21 D 22 A 23 D 24 D 25 D 26 C 27 B 28 C 29 D 30 B 31 C 32 B 33 B 34 C 35 B 36 A 37 B 38 D 39 D 40 A 41 D 42 C 43 A 44 A 45 B 46 C 47 B 48 D 49 A 50 D
Tài liệu đính kèm:
 HK_II_Hoa_12_GDTX.doc
HK_II_Hoa_12_GDTX.doc





