Đề Thi học kì I (2014- 2015) môn: Hóa học 9 - Đề A thời gian làm bài 45 phút
Bạn đang xem tài liệu "Đề Thi học kì I (2014- 2015) môn: Hóa học 9 - Đề A thời gian làm bài 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
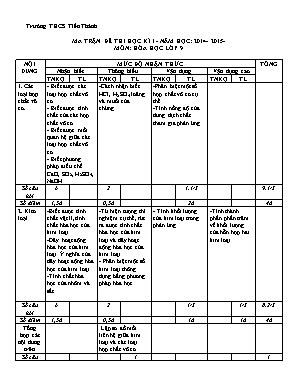
Trường THCS Tiến Thành MA TRẬN ĐỀ THI HỌC KÌ I - NĂM HỌC: 2014- 2015- MÔN: HÓA HỌC LỚP 9 NỘI DUNG MỨC ĐỘ NHẬN THỨC TỔNG Nhận biết Thông hiểu Vận dụng Vận dụng cao TNKQ TL TNKQ TL TNKQ TL TNKQ TL 1. Các loại hợp chất vô cơ. - Biết được các loại hợp chất vô cơ - Biết được tính chất của các hợp chất vô cơ - Biết được mối quan hệ giữa các loại hợp chất vô cơ. - Biết phương pháp điều chế CaO, SO2, H2SO4, NaOH -Cách nhận biết HCl, H2SO4 loãng và muối của chúng. -Phân biệt một số hợp chất vô cơ cụ thể -Tính nồng độ của dung dịch chất tham gia phản ứng Số câu hỏi 6 2 1.1/3 9.1/3 Số điểm 1,5đ 0,5đ 2đ 4đ 2. Kim loại -Biết được tính chất vật lí, tính chất hóa học của kim loại. -Dãy hoạt động hóa học của kim loại. Ý nghĩa của dãy hoạt động hóa học của kim loại. -Tính chất hóa học của nhôm và sắt. -Từ hiện tượng thí nghiệm cụ thể, rút ra được tính chất hóa học của kim loại và dãy hoạt động hóa học của kim loại. - Phân biệt một số kim loại thông dụng bằng phương pháp hóa học - Tính khối lượng của kim loại trong phản ứng. -Tính thành phần phần trăm về khối lượng của hỗn hợp hai kim loại Số câu hỏi 6 2 1/3 1/3 8.2/3 Số điểm 1,5đ 0,5đ 1đ 1đ 4đ Tổng hợp các nội dung trên Lập sơ đồ mối liên hệ giữa kim loại và các loại hợp chất vô cơ. Số câu hỏi 1 1 Số điểm 2đ 2đ Tổng số câu hỏi 12 4 1 1.2/3 1/3 19 Tổng số điểm 3đ 30% 3đ 30% 3đ 30% 1đ 10% 10đ 100% GV lập ma trận, ra đề và đáp án: Duyệt của BGH Phan Thanh Phong Trường THCS Tiến Thành THI HỌC KÌ I (2014- 2015) Họ- Tên HS: Môn: Hóa học 9- ĐỀ A Lớp: Thời gian làm bài 45 phút ĐIỂM LỜI NHẬN XÉT CỦA GV: Trắc nghiệm Tự luận Tổng cộng I. TRẮC NGHIỆM (4đ): Thời gian làm bài: 20 phút Khoanh tròn vào các chữ A, B, C hoặc D trước phương án trả lời đúng: Câu 1: Dãy các chất nào sau đây được xếp theo thứ tự oxit, axit, bazơ, muối: A. Na2O, HNO3, KOH, BaCl2 B. HCl, Ca(OH)2, SO3, ZnSO4 C. NaHCO3, H2SO4, Mg(OH)2, CO2 D. CaO, NaOH, H2S, NaNO3 Câu 2: Nhóm các muối nào sau đây tác dụng được với dung dịch Natri hiđroxit: A. NaCl, ZnCl2 B. MgSO4, KNO3 C. Na3PO4, K2CO3 D. CuCl2, ZnSO4 Câu 3: Dãy các bazơ vừa tác dụng được với dd axit, vừa bị nhiệt phân hủy là: A. NaOH, Ca(OH)2, Ba(OH)2 B. Mg(OH)2, Cu(OH)2, Fe(OH)2 C. Ca(OH)2, Cu(OH)2, NaOH D. KOH, Mg(OH)2, NaOH Câu 4: Sơ đồ nào sau đây phù hợp với mối quan hệ giữa các loại hợp chất vô cơ: A. Mg(OH)2 MgO MgCl2 B. Mg(NO3) MgCl2 MgSO4 C. MgO Mg(OH)2 MgSO4 D. MgCl2 MgSO4 Mg(OH)2 Câu 5: Trong phòng thí nghiệm, lưu huỳnh đioxit (SO 2) được điều chế bằng cách: A. cho muối Na2SO4 tác dụng dd HCl B. đốt lưu huỳnh trong không khí C. cho muối Na2SO3 tác dụng với dd HCl D. đốt quặng pirit sắt (FeS2) Câu 6: Cho phản ứng: 2 NaCl + 2H2O ..... .Những sản phẩm của phản ứng này là: A. NaOH, Cl2, H2 B. NaOH, H2 C. NaOH, Cl2 D. NaOH, H2O, Cl2 Câu 7: Kim loại nào sau đây dẫn nhiệt tốt nhất: A. Fe B. Ag C. Cu D. Al Câu 8: Nhóm các kim loại nào sau đây đều tác dụng được với dd axit sunfuric loãng: A. Zn, Mg, Fe B. Cu, Ag, Au C. Fe, Cu, Al D. Al, Ag, Zn Câu 9: Dãy các kim loại được sắp xếp theo mức độ hoạt động hóa học giảm dần là: A. Cu, Al, Zn, Na B. Mg, Al, Na, Ag C. Na, Mg, Zn, Cu D. Pb, Al, Mg , Fe Câu 10: Nhóm các kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường: A. K, Fe B. Na, Zn C. Cu, Ag D. K, Na Câu 11: Kim loại nhôm tác dụng với nhóm chất nào sau đây: A. NaOH, HCl, Cl2 B. HCl, H2O, S C. O2, Cu, Zn D. Cl2, H2SO4đ, H2O Câu 12: Tính chất hóa học nào sau đây không phải của kim loại sắt: A. tác dụng với H2O B. tác dụng với dd H2SO4 C. tác dụng với dd CuSO4 D. tác dụng với khí Cl2 Câu 13: Chất nào sau đây có thể dùng làm thuốc thử để phân biệt 2 dd: HCl và H2SO4 A. H2O B. NaCl C. Ba(OH)2 D. NaNO3 Câu 14: Để nhận biết 3 dd không màu: KCl, K2SO4, KNO3 ta dùng thuốc thử: A. dd BaCl2 và dd AgNO3 B. quì tím và dd BaCl2 C. dd AgNO3 D. quì tím Câu 15: Cho một dây đồng vào ống nghiệm chứa dung dịch AgNO3, xảy ra hiện tượng: A. Không có dấu hiệu phản ứng B. Có chất rắn màu xám bám ngoài dây đồng C. Có kết tủa xanh tạo thành D. Có chất khí bay ra, dung dịch không đổi màu Câu 16: Để phân biệt kim loại nhôm và sắt, ta có thể dùng chất nào sau đây: A. H2O B. dd HCl C. dd NaOH D. dd NaCl Họ- Tên HS: . Lớp: . ĐỀ A. II. TỰ LUẬN (6đ): Thời gian làm bài: 25 phút Câu 1(2đ): Cho các chất sau: Al(OH)3, AlCl3, Al, Al2(SO4)3, a. Xếp các chất trên thành chuỗi chuyển hóa. b. Viết PTHH thực hiện chuỗi chuyển hóa trên. Câu 2(1đ): Nêu phương pháp hoá học để phân biệt các dung dịch: NaOH , Na2CO3 và NaCl đựng trong các lọ mất nhãn riêng biệt. Viết phương trình hóa học xảy ra. Câu 3(3đ): Hòa tan 20 gam hỗn hợp bột Zn và Cu vào 400 ml dung dịch HCl, thấy có 2,24 lít khí thoát ra (ở điều kiện tiêu chuẩn ) a. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu b. Tính nồng độ mol của dung dịch axit đã phản ứng. c. Tính thành phần % về khối lượng của mỗi kim loại trong hỗn hợp ban đầu. (Biết: H =1; Cl = 35,5; Zn= 65; Cu = 64) ĐÁP ÁN ĐỀ THI HỌC KỲ I- (2014- 2015) MÔN: HÓA HỌC 9- ĐỀ A I . TRẮC NGHIỆM (4đ): Chọn đúng mỗi câu đạt 0,25đ Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Chọn A D B A C A B A C B A A C B B C II. TỰ LUẬN (6đ): Câu Nội dung Điểm 1 a. HS có thể xếp thành các chuỗi khác nhau, nếu hợp lý là được. b. Có 3 PTHH, viết đúng mỗi PTHH 0,5đ. *Lưu ý: Ở tất cả các PTHH: +Viết sai CTHH, không có điểm. +Cân bằng sai hoặc không cân bằng, không ghi đkpư, trừ tối đa 0,25đ/PT 0,5 đ 1,5 đ Câu Nội dung Điểm 2 - Nhúng quì tím vào các mẫu thử: + quì tím hóa xanh: dd NaOH + quì tím không đổi màu: dd Na2CO3 và dd NaCl - Dùng dd HCl nhận ra Na2CO3( có khí thoát ra), còn lại là NaCl - PTHH: 2HCl + Na2CO3 2NaCl + H2O + CO2 0,25đ 0,25đ 0,25đ 0,25đ Câu Nội dung Điểm 3a - Cho hh Zn và Cu vào dd HCl, Zn phản ứng, Cu không phản ứng - Số mol H2: - PTHH: Zn + 2HCl ZnCl2 + H2 1mol 2mol 1mol 0,1mol 0,2mol 0,1mol - KL mỗi kim loại trong hh: mZn = 0,1 x 65 = 6,5(g) mCu = 20 – 6,5 = 13,5(g) 0,25đ 0,25đ 0,5đ 0,5đ 0,25đ 0,25đ 3b - Nồng độ mol của dd HCl: 0,5đ 3c - Thành phần % về khối lượng của mỗi kim loại trong hh: %mZn = %mCu = 100 – 32,5 = 67,5(%) 0,25đ 0,25đ Trường THCS Tiến Thành THI HỌC KÌ I (2014- 2015) Họ- Tên HS: Môn: Hóa học 9- ĐỀ B Lớp: Thời gian làm bài 45 phút ĐIỂM LỜI NHẬN XÉT CỦA GV: Trắc nghiệm Tự luận Tổng cộng I. TRẮC NGHIỆM (4đ): Thời gian làm bài: 20 phút Khoanh tròn vào các chữ A, B, C hoặc D trước phương án trả lời đúng: Câu 1: Chất nào sau đây là muối: A. Natri hiđroxit B. Nhôm sunfua C. Bari oxit D. Oxit sắt từ Câu 2: Sắt không tác dụng được với chất nào sau đây: A. H2SO4 đặc, nguội B. CuSO4 C. O2 D. H2SO4 loãng Câu 3: Có thể dùng hóa chất nào sau đây để phân biệt 3 dung dịch: ZnSO4, ZnCl2 và HCl A. Kim loại Mg B. Quỳ tím C. Dung dịch BaCl2 D. Quỳ tím và dung dịch BaCl2 Câu 4: Chất nào sau đây được dùng để sản xuất vôi sống? A. CaCO3 B. Ca(OH)2 C. Na2CO3 D. K2CO3 Câu 5: Người ta sản xuất Natri hiđroxit bằng cách: A. Cho Na2CO3 tác dụng với Ba(OH)2 B. Điện phân dung dịch NaCl bão hòa có màng ngăn C. Cho Na2SO3 tác dụng với Ca(OH)2 D. Cho Na2SO3 tác dụng với Ba(OH)2 Câu 6: Do bền và nhẹ nên kim loại nào sau đây dùng để chế tạo vỏ máy bay: A. Nhôm B. Chì C. Kẽm D. Bạc Câu 7: Nhóm oxit nào sau đây tác dụng với nước: A. MgO, NO B. CuO, SO2 C. BaO, CO2 D. K2O, SiO2 Câu 8: Bazơ không tan có tính chất hóa học nào sau đây: A. Tác dụng với oxit axit B. Làm đổi màu quỳ tím thành xanh C. Tác dụng với dung dịch muối D. Bị nhiệt phân hủy Câu 9: Mối quan hệ nào sau đây không đúng: A. Axit muối oxit bazơ B. Oxit bazơ muối axit C. Bazơ muối axit D. Oxit axit axit muối Câu 10: Kim loại không có tính chất hóa học chung nào sau đây: A. Tác dụng với phi kim B. Tác dụng với dd axit C. Tác dụng với dung dịch bazơ D. Tác dụng với dung dịch muối Câu 11: Dãy các kim loại được xếp theo chiều hoạt động hóa học tăng dần là: A. K, Na, Fe, Cu B. Cu, Fe, Mg, Na C. Cu, Zn, Fe, Mg D. Ag, Cu, Al, Fe Câu 12: Nhôm có tính chất hóa học riêng nào: A. Tác dụng với oxi B. Tác dụng với axit C. Tác dụng với dung dịch bazơ D. Tác dụng với dung dịch muối Câu 13: Dùng dung dịch nào sau đây để phân biệt hai dung dịch muối: Na2SO4 và Na2CO3; A. HCl B. BaCl2 C. NaCl D. KOH Câu 14: Ngâm một sợi dây nhôm sạch vào dung dịch CuSO4, sau một thời gian ta thấy: A. không có hiện tượng gì B. có chất màu nâu đỏ bám vào dây nhôm C. có khí mùi hắc thoát ra D. có kết tủa màu nâu đỏ tạo thành Câu 15: Có thể dùng chất nào sau đây để phân biệt 2 kim loại: Al và Fe: A. Dung dịch HCl B. Dung dịch BaCl2 C. Dung dịch NaCl D. Dung dịch NaOH Câu 16: Nhóm kim loại nào sau đây tác dụng với axit HCl sinh ra chất khí: A. Fe, Zn B. Cu, Fe C. Ag, Cu D. Au, Al Họ- Tên HS: . Lớp: . ĐỀ B. II. TỰ LUẬN (6đ) Thời gian làm bài: 25 phút Câu 1(2đ). Cho các chất: Fe; Fe(OH)2; FeO; FeCl2 a/ Xếp các chất trên thành chuỗi chuyển hóa. b/ Viết PTHH thực hiện chuỗi chuyển hóa trên. Câu 2(1đ). Có 3 dung dịch đựng ở 3 lọ bị mất nhãn: K2SO4, KNO3, K2CO3. Hãy trình bày cách nhận biết mỗi dung dịch trên Câu 3(3đ). Cho 30 gam hỗn hợp gồm bột sắt và bột đồng tác dụng hết với 400 ml dung dịch axit clohiđric thấy có 6,72 lít khí hiđro thoát ra (ở đktc). a. Tính khối lượng mỗi kim loại trong hỗn hợp. b. Tính nồng độ mol của dung dịch axit clohiđric cần dùng. c. Tính thành phần phần trăm về khối lượng mỗi kim loại trong hỗn hợp ban đầu. (Fe= 56; Cu = 64; Cl = 35,5; H= 1) ĐÁP ÁN ĐỀ THI HỌC KỲ I- (2014- 2015) MÔN: HÓA HỌC 9- ĐỀ B I .Trắc nghiệm (4đ): Chọn đúng mỗi câu 0,25 đ Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Chọn B A B A B A C D A C B C A B D A II. Tự luận (6đ): Câu Nội dung Điểm 1 a. HS có thể xếp thành các chuỗi khác nhau, nếu hợp lý là được. b. Có 3 PTHH, viết đúng mỗi PTHH 0,5đ. *Lưu ý: Ở tất cả các PTHH: +Viết sai CTHH, không có điểm. +Cân bằng sai hoặc không cân bằng, không ghi đkpư, trừ tối đa 0,25đ/PT 0,5 đ 1,5 đ Câu Nội dung Điểm 2 - Dùng HCl nhận ra K2CO3 vì có xuất hiện bọt khí PTHH: K2CO3 + 2HCl 2KCl + CO2 + H2O - Dùng dung dịch BaCl2 nhận ra K2SO4 vì có xuất hiện kết tủa trắng PTHH: K2SO4 + BaCl2 BaSO4 + 2KCl - Còn lại là KNO3. 0,25đ 0,25đ 0,25đ 0,25đ Câu Nội dung Điểm 3 - Cho hỗn hợp Fe và Cu vào dung dịch HCl thì Fe phản ứng, Cu không phản ứng. -PTHH: Fe + 2HCl FeCl2 + H2 1mol 2mol 1mol 0,3mol 0,6mol 0,3mol -Số mol H2: = 0,3 (mol) a. Khối lượng sắt phản ứng: 0,3 . 56 = 16,8(g) Khối lượng đồng trong hh: 30 – 16,8 = 13,2 (g) b. Nồng độ mol của dung dịch axit: c. Thành phần % về KL của mỗi kim loại: + % mFe = +%mCu = 100% - 56%= 44% 0,25đ 0,5đ 0,5đ 0,25đ 0,25đ 0,25đ 0,5đ 0,25đ 0,25đ
Tài liệu đính kèm:
 hoa.doc
hoa.doc





