Đề kiểm tra 1 tiết lần 3 môn: Hoá học khối 12 (bài 1 - HK II)
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết lần 3 môn: Hoá học khối 12 (bài 1 - HK II)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
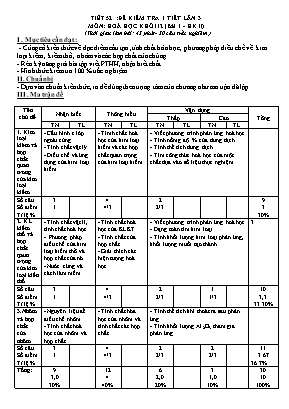
TIẾT 52 :ĐỀ KIỂM TRA 1 TIẾT LẦN 3 MÔN: HOÁ HỌC KHỐI 12 (Bài 1 - HK II) (Thời gian làm bái: 45 phút- 30 câu trắc nghiệm ) I . Mục tiêu cần đạt : - Củng cố kiến thức về đạc điểm cấu tạo ,tính chất hóa học , phương pháp điều chế về kim loại kiềm , kiềm thổ , nhôm và các hợp chất của chúng - Rèn kỹ năng giải bài tập viết PTHH, nhận biết chất . - Hình thức kiểm tra 100 % trắc nghiệm. II. Chuẩn bị - Dựa vào chuẩn kiến thức, ra đề đúng theo trọng tâm của chương như ma trận đã lập. III . Ma trận đề Tên chủ đề Nhận biết Thông hiểu Vận dụng Tổng Thấp Cao TN TL TN TL TN TL TN TL 1. Kim loại kièm và hợp chất quan trong của kim loại kiềm - Cấu hình e lớp ngoài cùng - Tính chất vật lý - Điều chế và ứng dụng của kim loại kiềm - Tímh chất hoá học của kim loại kiềm và các hợp chất quan trọng của kim loại kiềm - Viết phương trình phản ứng hoá học - Tính nồmg độ % của dung dịch - Tính thể tích dung dịch - Tìm công thức hoá học của một chất dựa vào số liệu thực nghiệm Số câu Số điểm Tỉ lệ % 3 1 4 4/3 2 2/3 9 3 30% 2. KL kiềm thổ và hợp chất qaun trọng của kim loại kiền thổ - Tính chất vật lí, tính chất hoá học - Phương pháp điều chế của kim loại kiềm thổ và hợp chất của nó - Nước cứng và cách làm mềm - Tính chất hoá học của KLKT - Tính chất của hợp chất - Giải thích các hiện tượng hoá học - Viết phương trình phản ứng hoá học - Dạng toán tìm kim loại - Tính khối lượng kim loại phản ứng, khối lượng muối tạo thành 3 Số câu Số điểm Tỉ lệ % 3 1 4 4/3 2 2/3 1 1/3 10 3,3 33.30% 3.Nhôm và hợp chất của nhôm - Nguyên liệu để điều chế nhôm - Tính chất hoá học của nhôm và hợp chất - Tính chất hóa học của nhôm và tính chất các hợp chất - Tính thể tích khí thoát ra sau phản ứng. - Tính khối lượng Al2O3 tham gia phản ứng Số câu Số điểm Tỉ lệ % 3 1 4 4/3 2 2/3 2 2/3 11 3.67 36.7% Tổng: 9 3,0 30% 12 4 40% 6 2,0 20% 3 1,0 10% 30 10 100% ĐỀ KIỂM TRA 1 TIẾT - Bài 1 HK II MÔN: HOÁ HỌC -ĐỀ 001 (Đề bài gồm có 02 trang, 30 câu trắc nghiệm) Họ Và Tên lớp 12..... B. Câu 1: Để bảo quản Na người ta ngâm Na trong : A. Dầu hoả B. Nước C. Ancol etylic D. Phenol lỏng B Câu 2 : Nhóm kim loại phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là : A. Na, K, Mg, Ca B. Ba, Na, K, Ca C. Ba, Mg, Ca, Ba D. K, Na, Ca, Zn B Câu 3: Cấu hình electron của nguyên tử kim loại kiềm là: A. ns2 B. ns1 C. ns2 np1 D. ns2 np3 B Câu 4: Nước cứng là nước chứa nhiều ion nào: A. Na+ và Mg2+ B. Ca2+ và Mg2+ C. K+ và Ba2+ D. Ba2+ và Ca2+ B Câu 5: Mg được điều chế bắng cách: A. Điện phân nóng chảy MgCl2 B. Cho Na vào dung dich MgSO4 C. Dùng H2 khử MgO ở nhiệt đọ cao D. Điện phân dung dịch Mg(NO)2 B Câu 6: Cặp chất nào sau đây thường dùng để làm mềm nước cứng: A. CaO và NaCl B. Ca(OH)2 và HCl C. HCl và Na2CO3 D. Na2CO3 và Na3PO4 B Câu 7: Kim loại pản ứng được với dung dich NaOH là: A. Fe B. Al C. Ag D. Cu B Câu 8: Hợp chất nào sau đây có tính lưỡng tính: A. Fe2O3 B. Fe(OH)3 C. NaOH D. Al2O3 B Câu 9: Phèn chua được dùng để làm trong nước đục. Công thức của phèn chua là A. K2SO4.Cr2(SO4)3.24H2O. B. NH4Fe(SO4)2.12H2O. C. KAl(SO4)2.12H2O. D. (NH4)2SO4.Al2(SO4)3.24H2O. Câu 10: Để điều chế kim loại Na từ NaOH người ta thực hiện phản ứng: A. Điện phân dung dịch NaOH B. Điện phân nóng chảy NaOH C. Cho dung dịch NaOH tác dụng với HCl D. Cho NaOH tác dụng với H2O Câu 11: Cấu hình e của cation R+ có phân lớp ngoài cùng là 2p6. Nguyên tử R là: A. K B. Li C. Na D. Mg Câu 12: Dung dịch NaOH phản ứng được với dung dịch nào sau đây: A. KCl B. KNO3 C. FeCl3 D. K2SO4 Câu 13: Kim lọai nào sau đây tác dụng với clo và HCl cho cùng một loại muối: A. Cu B. Mg C. Fe D. Ag Câu 14: Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có A. bọt khí và kết tủa trắng. B. bọt khí bay ra. C. kết tủa trắng xuất hiện. D. kết tủa trắng sau đó kết tủa tan dần. Câu 15: Cho sơ đồ chuyển hoá sau: Công thức của X, Y, Z lần lượt là: A. HCl, HNO3, Na2CO3. B. Cl2, HNO3, CO2. C. HCl, AgNO3, (NH4)2CO3. D. Cl2, AgNO3, MgCO3. Câu 16:: Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là A.4. B. 7. C. 5. D. 6. Câu 17:: Nhỏ từ từ đến dư dung dich NaOH vào dung dịch AlCl3. Hiện tượng sảy ra là: A. Có kết tủa keo trắng sau đó kết tủa tan B. Chỉ có kết tủa keo trắng C. Có kết tủa keo trắng và có khí bay lên D. Không có kết tủa keo trắng có khí bay lên Câu 18: Nhôm khử được oxit trong dãy nào sau đây: A. CaO, ZnO, Fe2O3 B. CuO, CaO, ZnO C. Na2O, CuO, Fe2O3 D. ZnO, CuO, Fe2O3 Câu 19: Bình bằng nhôm có thể đựng được axit nào sau đây: A. HNO3 đặc nóng B. H3PO4 C. HNO3 đặc nguội D. HCl Câu 20: Dãy gồm các chất vừa tan trong dung dịch HCl, vừa tan trong dung dịch NaOH là: A. NaHCO3, MgO, Ca(HCO3)2. B. NaHCO3, ZnO, Mg(OH)2. C. NaHCO3, Ca(HCO3)2, Al2O3. D. Mg(OH)2, Al2O3, Ca(HCO3)2. Câu 21: Cho 2,3 gam Na tác dụng với 180 gam H2O nồng độ phần trăm của dung dịch thu được là: A. 4,389 % B. 2,195 % C. 1,261 % D. 2,22 % Câu 22: Điện phân nóng chảy hoàn toàn 7,45 gam muối clorua cuả kim loại hoá trị I, thu được 1,12 lít khí ở anot. Kim loại đó là: A. Na B. Li C. Cs D. K Câu 23: Cho 10 lít hỗn hợp khí (đktc) gồm CO2 và 68,64% CO về thể tích đi qua 100 gam dung dịch Ca(OH)2 7,4% thấy tách ra m gam kết tủa. Trị số của m bằng A. 10 gam. B. 8 gam. C. 6 gam. D. 12 gam. Câu 24: Dẫn V lit CO2 (đktc) vào dung dịch Ca(OH) 2 thu được 25 gam kết tủa và dung dịch X, đun nóng dung dịch lại thu thêm được 5 gam kết tủa nữa. Giá trị của V là : A. 7,84 lit B. 11,2 lit C. 6,72 lit D. 5,6 lit Câu 25: Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là (Cho Al = 27) A. 3,36 lít. B. 2,24 lít. C. 4,48 lít. D. 6,72 lít. Câu 26: Khối lượng Al2O3 cần dùng để điều chế 162 gam nhôm với hiệu suất phản ứng 90% là: A. 340 g B. 275,4 g C. 550,8 g D. 306 g Câu 27: Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là (cho H = 1, O = 16, Al = 27) A. 1,2. B. 1,8. C. 2,4. D. 2. Câu 28: Chia m gam Al thành hai phần bằng nhau: - Phần một tác dụng với lượng dư dung dịch NaOH, sinh ra x mol khí H2. - Phần hai tác dụng với lượng dư dung dịch HNO3 loãng, sinh ra y mol khí N2O (sản phẩm khử duy nhất). Quan hệ giữa x và y làM A. x = 2y. B. y = 2x. C. x = 4y. D. x = y. Câu 29: Để thu được Al2O3 từ hỗn hợp Al2O3 và Fe2O3, người ta lần lượt dùng A. khí H2 ở nhiệt độ cao, dung dịch NaOH (dư). B. khí CO ở nhiệt độ cao, dung dịch HCl (dư). C. dung dịch NaOH (dư), dung dịch HCl (dư), rồi nung nóng. D. dung dịch NaOH (dư), khí CO2 (dư), rồi nung nóng. Câu 30: Cho một mẫu hợp kim Na - Ba tác dụng với nước (dư), thu được dung dịch X và 3,36 lít H2 (ở đktc). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hoà dung dịch X là A. 150 ml. B. 75 ml. C. 60 ml. D. 30 ml. Hết PHIẾU TRẢ LỜI TRẮC NGHIỆM Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 ĐA Câu 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 ĐA ĐỀ KIỂM TRA 1 TIẾT - Bài 1 HK II MÔN: HOÁ HỌC -ĐỀ 002 (Đề bài gồm có 02 trang, 30 câu trắc nghiệm) Họ Và Tên lớp 12..... Câu 1: Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là (cho H = 1, O = 16, Al = 27) A. 1,2. B. 1,8. C. 2,4. D. 2. Câu 2: Cặp chất nào sau đây thường dùng để làm mềm nước cứng: A. CaO và NaCl B. Ca(HO)2 và HCl C. HCl và Na2CO3 D. Na2CO3 và Na3PO4 Câu 3: Nhôm khử được oxit trong dãy nào sau đây: A. CaO, ZnO, Fe2O3 B. CuO, CaO, ZnO C. Na2O, CuO, Fe2O3 D. ZnO, CuO, Fe2O3 Câu 4: Bình bằng nhôm có thể đựng được axit nào sau đây: A. HNO3 đặc nóng B. H3PO4 C. HNO3 đặc nguội D. HCl Câu 5: Công thức của thạch cao sống là: A. CaSO4 B. CaSO4.2H2O C. CaSO4.H2O D. 2CaSO4.H2O Câu 6: Nhôm không tan được trong dung dịch: A. HCl B. NaOH C. NaHSO4 D. Na2SO4 Câu 7: Dung dịch làm quỳ tím chuyển sang màu xanh là: A. Na2CO3 B. NaNO3 C. NaHSO4 D. NaCl Câu 8: Hoà tan m gam Al vào dung dịch HNO3 rất loãng chỉ thu được hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO. Giá trị của m là A. 8,1 gam. B. 1,53 gam. C. 1,35 gam. D. 13,5 gam. Câu 9: Điện phân nóng chảy hoàn toàn 7,45 gam muối clorua cuả kim loại hoá trị I, thu được 1,12 lít khí ở anot. Kim loại đó là: A. Na B. Li C. Cs D. K Câu 10 : Để bảo quản Na người ta ngâm Na trong : A. Dầu hoả B. Nước C. Ancol etylic D. Phenol lỏng Câu 11 : Nhóm kim loại phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là : A. Na, K, Mg, Ca B. Ba, Na, K, Ca C. Ba, Mg, Ca, Ba D. K, Na, Ca, Zn Câu 12: Dung dịch NaOH phản ứng được với dung dịch nào sau đây: A. KCl B. KNO3 C. FeCl3 D. K2SO4 Câu 13: Kim loại pản ứng được với dung dich NaOH là: A. Fe B. Al C. Ag D. Cu Câu 14: Để điều chế kim loại Na từ NaOH người ta thực hiện phản ứng: A. Điện phân dung dịch NaOH B. Điện phân nóng chảy NaOH C. Cho dung dịch NaOH tác dụng với HCl D. Cho NaOH tác dụng với H2O Câu 15: Cho 2,3 gam Na tác dụng với 180 gam H2O nồng độ phần trăm của dung dịch thu được là: A. 4,389 % B. 2,195 % C. 1,261 % D. 2,22 % Câu 16: Cấu hình electron của nguyên tử kim loại kiềm là: A. ns2 B. ns1 C. ns2 np1 D. ns2 np3 Câu 17: Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có A. bọt khí và kết tủa trắng. B. bọt khí bay ra. C. kết tủa trắng xuất hiện. D. kết tủa trắng sau đó kết tủa tan dần. Câu 18: Cho 10 lít hỗn hợp khí (đktc) gồm CO2 và 68,64% CO về thể tích đi qua 100 gam dung dịch Ca(OH)2 7,4% thấy tách ra m gam kết tủa. Trị số của m bằng A. 10 gam. B. 8 gam. C. 6 gam. D. 12 gam. Câu 19: kim loại có thẻ điều chế từ quặng boxit là: A. Cu B. Mg C. Al D. Fe Câu 20: Kim loại nào sau đây được dùng để chế tạo tế bào quang điện: A. Cs B. Rb C. Na D. K Câu 21: Hợp chất nào sau đây có tính lưỡng tính: A. Fe2O3 B. Fe(OH)3 C. NaOH D. Al2O3 Câu 22: Nước cứng là nước chứa nhiều ion nào: A. Na+ và Mg2+ B. Ca2+ và Mg2+ C. K+ và Ba2+ D. Ba2+ và Ca2+ Câu 23: Nhỏ từ từ đến dư dung dich NaOH vào dung dịch AlCl3. Hiện tượng sảy ra là: A. Có kết tủa keo trắng sau đó kết tủa tan B. Chỉ có kết tủa keo trắng C. Có kết tủa keo trắng và có khí bay lên D. Không có kết tủa keo trắng có khí bay lên Câu 24: Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là (Cho Al = 27) A. 3,36 lít. B. 2,24 lít. C. 4,48 lít. D. 6,72 lít. Câu 25: Khối lượng Al2O3 cần dùng để điều chế 162 gam nhôm với hiệu suất phản ứng 90% là: A. 340 g B. 275,4 g C. 550,8 g D. 306 g Câu 26: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 2,5 lít dung dịch Ca(OH)2 0,03M. Số gam kết tủa thu được là: A. 5 g B. 2,5 g C. 10 g D. 7,5 g Câu 27: Mg được điều chế bắng cách: A. Điện phân nóng chảy MgCl2 B. Cho Na vào dung dich MgSO4 C. Dùng H2 khử MgO ở nhiệt đọ cao D. Điện phân dung dịch Mg(NO)2 Câu 28: Hòa tan hết m gam hỗn hợp Al và Fe trong lượng dư dung dịch H2SO4 loãng thoát ra 0,4 mol khí, còn trong lượng dư dung dịch NaOH thì thu được 0,3 mol khí. Giá trị m đã dùng là: A. 11,00 gam. B. 12,28 gam. C. 13,70 gam. D. 19,50 gam. Câu 29: Cấu hình e của cation R+ có phân lớp ngoài cùng là 2p6. Nguyên tử R là: A. K B. Li C. Na D. Mg Câu 30: Kim lọai nào sau đây tác dụng với clo và HCl cho cùng một loại muối: A. Cu B. Mg C. Fe D. Ag Hết PHIẾU TRẢ LỜI TRẮC NGHIỆM Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 ĐA D D D C B D A C D A B C B B B Câu 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 ĐA B C C C A D B A D A B A A C B
Tài liệu đính kèm:
 MA_TRAN_DE_KIEM_TRA_1_TIET_LAN_3.doc
MA_TRAN_DE_KIEM_TRA_1_TIET_LAN_3.doc





