Bài giảng Hóa học Lớp 8 - Tiết 21: Định luật bảo toàn khối lượng
Bạn đang xem tài liệu "Bài giảng Hóa học Lớp 8 - Tiết 21: Định luật bảo toàn khối lượng", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
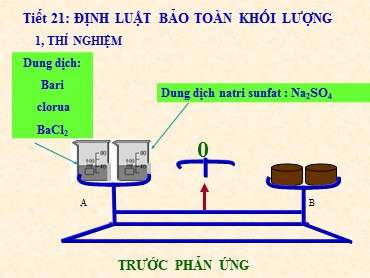
Tiết 21: ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG 1, THÍ NGHIỆM TRƯỚC PHẢN ỨNG Dung dịch: Bari clorua BaCl 2 Dung dịch natri sunfat : Na 2 SO 4 0 A B Tiết 21 : ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG 1, THÍ NGHIỆM 0 Dung dịch natri sunfat : Na 2 SO 4 SAU PHẢN ỨNG SAU PHẢN ỨNG Dấu hiệu nào chứng tỏ có phản ứng hóa học xảy ra ? Em có nhận xét gì về vị trí của kim cân trước và sau phản ứng ?. Trả lời : Dấu hiệu cho thấy phản ứng hóa học xảy ra là có chất màu trắng xuất hiện. Trước và sau phản ứng vị trí kim cân không thay đổi. Trả lời : Phương trình chữ của phản ứng: Bari clorua + Natri sunfat Bari sunfat + Natri clorua Biết hai chất mới sinh ra là Bari sunfat và Natri clorua. Hãy viết phương trình chữ của phản ứng trong thí nghiệm trên ? Tiết 21: ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG 1, Thí nghiệm Kim cân trước và sau phản ứng không thay đổi chứng tỏ điều gì ? Qua thí nghiệm em thử rút ra nội dung định luật ? Kim cân trước và sau phản ứng không thay đổi chứng tỏ khối lượng các chất sản phẩm bằng khối lượng các chất tham gia phản ứng. Định luật : “ Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”. 2, ĐỊNH LUẬT: “ Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng” a, Phát biểu: b, Giải thích : ( Trang 53 SGK ) Tiết21 : ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG 1, Thí nghiệm: Phương trình chữ của phản ứng: Bari clorua + Natri sunfat Bari sunfat + Natri clorua 3, Áp dụng Giả sử : A và B là hai chất phản ứng. C và D là hai chất sản phẩm. Gọi m lần lượt là khối lượng của A, B, C, D. Công thức về khối lượng: m A + m B = m C + m D Trong thí nghiệm trên biết rằng sản phẩm sinh ra là BaSO 4 và NaCl Hãy viết công thức khối lượng của phản ứng trong thí nghiệm trên ? m BaCl 2 + m Na 2 SO 4 = m BaSO 4 + m NaCl Gọi a, b, c là khối lượng đã biết của 3 chất x là khối lượng của chất chưa biết ta có : a + b = c + x, hay a + x = b + c. _ Hãy tìm x ? x = ( b + c ) – a. Tóm lại : Theo công thức về khối lượng: Trong một phản ứng có ( n ) chất, kể cả chất phản ứng và sản phẩm nếu biết ( n – 1 ) chất thì tính được khối lượng của chất còn lại. Bài tập: 1, Trong phản ứng hóa học ở thí nghiệm trên, Biết khối lượng của Natri sunfat Na 2 SO 4 là 14,2 gam, Khối lượng của các sản phẩm Bari sunfat BaSO 4 là 23,3 gam, Natri Clorua NaCl là 11,7 gam. Hãy tính khối lượng của Bariclorua đã phản ứng ? Giải : Ta có : m BaCl 2 + m Na 2 SO 4 = m BaSO 4 + m NaCl x g 14,2 g 23,3 g 11,7 g x + 14,2 = 23,3 + 11,7 → x = ( 23,3 + 11,7 ) – 14,2 = 20,8 g 2, Đốt cháy hết 9 gam kim loại magiê Mg trong không khí thu được 15 gam hợp chất Magiê Oxit MgO. Biết rằng Magiê cháy là xảy ra phản ứng với khí Oxi O 2 có trong không khí. a, Viết công thức về khối lượng của phản ứng xảy ra. b, Tính khối lượng của khí oxi đã phản ứng . Đáp án : a, m Mg + m O 2 = m MgO. b, Gọi x là khối lượng của khí oxi, ta có: 9 + x = 15 x = 15 – 9 = 6 gam 1, ĐỊNH LUẬT: “ Trong một phản ứng hóa học, tổng khối lượng các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”. 2, ÁP DỤNG: Trong một phản ứng có n chất, kể cả chất phản ứng và sản phẩm nếu biết ( n – 1 ) chất thì tính được khối lượng của chất còn lại. KẾT LUẬN:
Tài liệu đính kèm:
 bai_giang_hoa_hoc_lop_8_tiet_21_dinh_luat_bao_toan_khoi_luon.ppt
bai_giang_hoa_hoc_lop_8_tiet_21_dinh_luat_bao_toan_khoi_luon.ppt






