Đề kiểm tra giữa kì I môn Khoa học tự nhiên Lớp 8 (Chân trời sáng tạo) - Năm học 2023-2024 - Trường PTDTBT THCS Phìn Ngan (Có đáp án)
Câu 1: Khi đun nóng hoá chất trong ống nghiệm cần kẹp ống nghiệm bằng kẹp ở khoảng bao nhiêu so với ống nghiệm tính từ miệng ống?
A. 1/2. B. 1/4. C. 1/6. D. 1/3.
Câu 2: Ampe kế dùng để làm gì?
A. Đo hiệu điện thế. B. Đo cường độ dòng điện.
C. Đo chiều dòng điện. D. Kiểm tra có điện hay không.
Câu 3: Các thí nghiệm về điện ở môn Khoa Học Tự Nhiên thường dùng nguồn điện để có bộ nguồn 6V thì dùng pin nào?
A. Một pin 3V. B. Hai pin 3V. C. Ba pin 2V. D. Bốn pin 1,5V.
Câu 4: Khi dùng đèn điot phát quang cần chú ý điều gì?
A. Cực (+) nối với cực dương của nguồn.
B. Cực (-) nối với cực dương của nguồn.
C. Cả A,B đều sai.
D. Cả A,B đều đúng.
Câu 5: Biến đổi vật lí là gì?
A. Chuyển trạng thái này sang trạng thái khác.
B. Chuyển nồng độ này sang nồng độ khác.
C. Chuyển từ thể tích này sang thể tích khác.
D. Tất cả các đáp trên.
Câu 6: Chất được tạo thành sau phản ứng hóa học là?
A. Chất phản ứng. B. Chất lỏng. C. Chất sản phẩm. D. Chất khí.
Câu 7: Dùng nước mưa đun sôi rồi để nguội làm nước uống, lâu ngày thấy trong ấm có những cặn trắng. Biết rằng trong nước mưa có chứa nhiều muối calcium hydrogen carbonate (Ca(HCO3)2). Muối này dễ bị nhiệt phân hủy sinh ra calcium carbonate (là chất kết tủa trắng), khí carbon dioxide và nước. Hãy cho biết dấu hiệu có phản ứng xảy ra khi đun nước sôi rồi để nguội.
A. Do tạo thành nước. B. Do tạo thành chất kết tủa trắng calcium carbonate.
C. Do để nguội nước. D. Do đun sôi nước
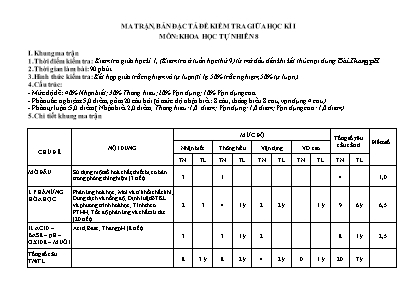
MA TRẬN, BẢN ĐẶC TẢ ĐỀ KIỂM TRA GIỮA HỌC KÌ I MÔN: KHOA HỌC TỰ NHIÊN 8 I. Khung ma trận 1. Thời điểm kiểm tra: Kiểm tra giữa học kì 1, (Kiểm tra ở tuần học thứ 9) từ mở đầu đến khi kết thúc nội dung: Bài Thang pH 2. Thời gian làm bài: 90 phút. 3. Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 50% trắc nghiệm, 50% tự luận). 4. Cấu trúc: - Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao. - Phần trắc nghiệm: 5,0 điểm, gồm 20 câu hỏi (ở mức độ nhận biết: 8 câu, thông hiểu 8 câu, vận dụng 4 câu) - Phần tự luận: 5,0 điểm ( Nhận biết 2,0 điểm; Thông hiểu: 1,0 điểm; Vận dụng: 1,0 điểm; Vận dụng cao: 1,0 điểm) 5. Chi tiết khung ma trận CHỦ ĐỀ NỘI DUNG MỨC ĐỘ Tổng số yêu cầu cần đ Điểm số Nhận biết Thông hiểu Vận dụng VD cao TN TL TN TL TN TL TN TL TN TL MỞ ĐẦU Sử dụng một số hoá chất, thiết bị cơ bản trong phòng thí nghiệm (3 tiết) 3 1 4 1,0 I. PHẢN ỨNG HÓA HỌC Phản ứng hoá học; Mol và tỉ khối chất khí; Dung dịch và nồng độ; Định luật BTKL và phương trình hoá học; Tính theo PTHH; Tốc độ phản ứng và chất xứ tác (20 tiết) 2 3 4 1 ý 2 2 ý 1 ý 9 6 ý 6,5 II. ACID – BASE – pH – OXIDE – MUỐI Acid; Base; Thang pH (8 tiết) 3 3 1 ý 2 8 1 ý 2,5 Tổng số câu TN/TL 8 3 ý 8 2 ý 4 2 ý 0 1 ý 20 7 ý Điểm số 2,0 2,0 2,0 1,0 1,0 1,0 0 1,0 5,0 5,0 10,0 Tỉ lệ % 20% 20% 20% 10% 10% 10% 10% 50% 50% 100% Tổng số điểm 4 điểm 3 điểm 2 điểm 1 điểm 10 điểm 10 điểm 40% 30% 20% 10% 100% II. Bảng đặc tả mã đề 01 Nội dung Mức độ Yêu cầu cần đạt Số ý TL/ Số câu hỏi TN Câu hỏi TL (số ý) TN (số câu) TL (số ý) TN (số câu) MỞ ĐẦU 4 1. Làm quen với bộ dụng cụ, thiết bị thực hành môn KHTN 8 Nhận biết Nhận biết được một số dụng cụ, hóa chất. Nêu được quy tắc sử dụng hóa chất an toàn. Nhận biết được các thiết bị điện trong môn KHTN. 3 C1, 2, 3 Thông hiểu - Trình bày được cách sử dụng điện an toàn. 1 C4 PHẢN ỨNG HÓA HỌC 6 ý 8 1. Biến đổi vật lí và hoá học. Phản ứng hoá học và NL Nhận biết - Nêu được khái niệm, đưa ra được ví dụ minh họa và phân biệt được 2 C5,6 biến đổi vật lý, biến đổi hóa học. Nêu được khái niệm phản ứng hóa học, chất đầu và sản phẩm Nêu được sự sắp xếp khác nhau của các nguyên tử trong phân tử chất đầu và sản phẩm. Nêu được khái niệm về phản ứng thu nhiệt, tỏa nhiệt. Thông hiểu - Chỉ ra được một số dấu hiệu chứng tỏ có phản ứng hóa học xảy ra. 1 C7 Vận dụng Tiến hành được một số thí nghiệm về biến đổi vật lý và biến đổi hóa học. Ứng dụng phản ứng thu nhiệt, tỏa nhiệt vào đời sống. 2. Mol và tỉ khối chất khí Nhận biết Nêu được khái niệm mol. Nêu được khái niệm tỉ khối, viết được công thức tính tỉ khối của chất khí. Nêu được khái niệm thể tích mol của chất khí ở áp suất 1 bar và 25oC. 1 C21 a Thông hiểu Tính được khối lượng mol và chuyển đổi được giữa số mol và khối lượng. So sánh được chất khí này nặng hay nhẹ hơn chất khí khác. 2 C 8, 9 Vận dụng - Sử dụng được các công thức để chuyển đổi giữa số mol và thể tích chất khí ở điều kiện chuẩn: 1 bar và 25oC 2 C10, 11 3. Dung dịch và nồng độ Nhận biết Nêu được dung dịch là hỗn hợp đồng nhất cả các chất đac tan trong nhau. Nêu được định nghĩa độ tan của một chất trong nước, nồng độ %, nồng độ mol. 1 C21 b Thông hiểu - Tính được độ tan, nồng độ %, nồng độ mol theo công thức. Vận dụng - Tiến hành được thí nghiệm pha một dung dịch theo một nồng độ cho trước. Vận dụng cao - Tính được khối lượng dung dịch đã biết nồng độ dùng để pha dung dịch mới với nồng độ khác. 4. Định luật bảo toàn khối lượng và phương trình hóa học Nhận biết Phát biểu được định luật bảo toàn khối lượng. Áp dụng định luật bảo toàn khối lượng và phương trình hóa học để tìm khối lượng chất chưa biết. Nêu được khái niệm phương trình hóa học và các bước lập phương trình hóa học. Thông hiểu - Trình bày được ý nghĩa của phương trình hóa học 1 ý Câu 22 b Vận dụng - Lập được sơ đồ phản ứng hóa học dạng chữ và phương trình hóa học của một số phản ứng cụ thể. 1 C12 5. Tính theo phương trình hóa học Nhân biết - Nêu được khái niệm, công thức tính của hiệu suất phản ứng Thông hiểu - Tính đươc chất lượng phương trình hóa học theo số mol, khối lượng hoặc thể tích ở điều kiện 1 bar và 25oC. 2 ý 1 Câu 23 a, b C13 Vận dụng - Tính được hiệu suất một phản ứng dựa vào lượng sản phẩm thu được theo lý thuyết và lượng sản phẩm thu được theo thực tế. 1 C14 Vận dụng cao - Tính được hiệu suất một phản ứng dựa vào lượng sản phẩm thu được theo lý thuyết và lượng sản phẩm thu được theo thực tế của hỗn hợp khí 1 ý Câu 25 6. Tốc độ phản ứng và chất xúc tác Nhận biết Nêu được khái niệm về tốc độ phản ứng Trình bày được một số yếu tố ảnh hưởng đến tốc độ phản ứng và nêu được một số ứng dụng. thực tế. 1 ý Câu 22 a Thông hiểu So sánh được tốc độ của một số phản ứng hóa học Trình bày được các yếu tố làm thay đổi tốc độ phản ứng Nhận biết được các loại chất xúc tác. II. ACID – BASE – pH – OXIDE – MUỐI 1 ý 6 7. Acid Nhận biết Nêu được khái niệm acid (tạo ra ion H+) Nêu được các tính chất hóa học của acid. 2 C15, 16 Thông hiểu - Giải thích được các hiện tượng xảy ra trong thí nghiệm với dung dịch acid. 2 C17, 18 Vận dụng -Trình bày và ứng dụng một số acid thông dụng vào đời sống. - Tính được chất còn dư sau phản ứng trung hòa. Vận dụng cao - Tính được thể tích hỗn hợp dung dịch acid cần dùng để hòa tan một khối lượng kim loại cho trước. 8. Base. Thang pH Nhận biết Nêu được khái niệm base, kiềm là các ion tan tốt trong nước. - Dung dịch base làm đổi màu các chất chỉ thị như quỳ tím, phenolphtalein. 1 C19 Thông hiểu - Tiến hành được thí nghiệm base là làm đổi màu chất chỉ thị, phản ứng với acid tạo muối, nêu và giải thích được hiện tượng xảy ra trong thí nghiệm (viết phương trình hoá học) và rút ra nhận xét về tính chất của base. - - Sử dụng bảng tính tan để phân biệt hydroxide thuộc loại kiềm hoặc base không tan. - Nhận biết dung dịch base 1 ý 1 Câu 24 C20 Vận dụng Liên hệ được pH trong dạ dày, máu, trong nước mưa, đất. Vận dụng tính chất của base vào trong thực tiễn. Trường PTDTBT&THCS ĐỀ KIỂM TRA GIỮA KÌ I PHÌN NGAN MÔN: KHOA HỌC TỰ NHIÊN LỚP 8 ( Thời gian: 90 phút không kể phát đề ) ĐỀ 1 Phần I. Trắc nghiệm khách quan: (5,0 điểm) Khoanh tròn vào chữ cái trước câu trả lời đúng: Câu 1: Khi đun nóng hoá chất trong ống nghiệm cần kẹp ống nghiệm bằng kẹp ở khoảng bao nhiêu so với ống nghiệm tính từ miệng ống? A. 1/2. B. 1/4. C. 1/6. D. 1/3. Câu 2: Ampe kế dùng để làm gì? A. Đo hiệu điện thế. B. Đo cường độ dòng điện. C. Đo chiều dòng điện. D. Kiểm tra có điện hay không. Câu 3: Các thí nghiệm về điện ở môn Khoa Học Tự Nhiên thường dùng nguồn điện để có bộ nguồn 6V thì dùng pin nào? A. Một pin 3V. B. Hai pin 3V. C. Ba pin 2V. D. Bốn pin 1,5V. Câu 4: Khi dùng đèn điot phát quang cần chú ý điều gì? A. Cực (+) nối với cực dương của nguồn. B. Cực (-) nối với cực dương của nguồn. C. Cả A,B đều sai. D. Cả A,B đều đúng. Câu 5: Biến đổi vật lí là gì? A. Chuyển trạng thái này sang trạng thái khác. B. Chuyển nồng độ này sang nồng độ khác. C. Chuyển từ thể tích này sang thể tích khác. D. Tất cả các đáp trên. Câu 6: Chất được tạo thành sau phản ứng hóa học là? A. Chất phản ứng. B. Chất lỏng. C. Chất sản phẩm. D. Chất khí. Câu 7: Dùng nước mưa đun sôi rồi để nguội làm nước uống, lâu ngày thấy trong ấm có những cặn trắng. Biết rằng trong nước mưa có chứa nhiều muối calcium hydrogen carbonate (Ca(HCO 3)2). Muối này dễ bị nhiệt phân hủy sinh ra calcium carbonate (là chất kết tủa trắng), khí carbon dioxide và nước. Hãy cho biết dấu hiệu có phản ứng xảy ra khi đun nước sôi rồi để nguội. A. Do tạo thành nước. B. Do tạo thành chất kết tủa trắng calcium carbonate. C. Do để nguội nước. D. Do đun sôi nước Câu 8: Cho tỉ khối của khí A đối với khí B là 14 và tỉ khối của khí B đối với không khí là 0,069. Khối lượng mol của khí A là: A. 2 B. 28 C. 32 D. 64 Câu 9: Tỉ khối hơi của khí sulfur dioxide (SO2) so với khí chlorine (Cl2) là A. 0,19 B. 1,5 C. 0,9 D. 1,7 Câu 10: Ở 25 oC và 1 bar, 1,5 mol khí chiếm thể tích bao nhiêu? A. 31.587 l. B.35,187 l. C. 38,175 l. D. 37,185 l Câu 11: Hãy cho biết 64g khí oxi ở 1 bar và 25oC có thể tích là: A. 4,958 lít. B. 49,58 lít. C. 24,79 lít. D. 2,479 lít. Câu 12: Phương trình đúng của phosphorus cháy trong không khí, biết sản phẩm tạo thành là P2O5 A. P + O2 → P2O5 B. 4P + 5O2 → 2P2O5 C. P + 2O2 → P2O5 D. P + O2 → P2O3 Câu 13: Sulfur cháy theo sơ đồ phản ứng sau: Sulfur + khí oxygen → sulfur dioxide. Nếu đốt cháy 48 gam sulfur thì khối lượng oxygen đã tham gia vào phản ứng là: A. 40 gam B. 44 gam C. 48 gam D. 52 gam Câu 14: Trộn 10,8 gam bột nhôm (aluminium) với bột lưu huỳnh (sulfur). Cho hỗn hợp vào ống nghiệm và đun nóng để phản ứng xảy ra thu được 25,5 gam Al2S3. Tính hiệu suất phản ứng? A. 85% B. 80% C. 90% D. 92% Câu 15: Điền vào chỗ trống: "Acid là những ... trong phân tử có nguyên tử ... liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion ..." A. Đơn chất, hydrogen, OH− B. Hợp chất, hydroxide, H+ C. Đơn chất, hydroxide, OH− D. Hợp chất, hydrogen, H+ Câu 16: Acid là những chất làm cho quỳ tím chuyển sang màu nào trong số các màu sau đây? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 17: Sulfuric acid đặc nóng tác dụng với đồng kim loại sinh ra khí: A. CO2. B. SO2. C. SO3. D. H2S. Câu 18: Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí: A.BaO và H2SO4 C. BaCO3 và H2SO4 Ba(OH)2 và H2SO4 D. Na2O và H2SO4 Câu 19: Điền vào chỗ trống: “Base là những ... trong phân tử có nguyên tử kim loại liên kết với nhóm .... Khi tan trong nước, base tạo ra ion ...” A. Đơn chất, hydrogen, OH− B. Hợp chất, hydroxide, OH− C. Đơn chất, hydroxide, H+ D. Hợp chất, hydrogen, H+ Câu 20: Base nào là kiềm? A. Ba(OH)2. B. Cu(OH)2. C. Mg(OH)2. D. Fe(OH)2. Phần II. Tự luận (5,0điểm) Câu 21. ( 1 điểm ) a. Nêu khái niệm khối lượng mol. b. Dung dịch là gì? Câu 22. (1,5điểm) a. Hãy nêu các yếu tố làm thay đổi tốc độ phản ứng. b. Cho 13 gam zinc (Zn) tác dụng với dung dịch hydrochloric acid (HCl) thu được 27,2 gam ZnCl2 và 0,4 gam khí H2. Tính khối lượng của HCl đã phản ứng. Câu 23. (1,0điểm) Hòa tan hết 0,56 gam Fe trong dung dịch hydrochloric acid (HCl) 2M, sau phản ứng thu được FeCl2 và khí H2. a. Tính thể tích khí H 2 ở 25 độ C và 1 bar. b. Tinh thể tích dung dịch hydrochloric acid đã dùng. Câu 24. (0,5điểm) Có 2 lọ mất nhãn đựng 2 dung dịch NaOH và NaCl, hãy nêu cách nhận biết 2 dung dịch trên? Câu 25. (1,0điểm) Đốt 16 lít CO trong bình với 6 lít O2. Sau phản ứng thu được 18 lít hỗn hợp khí. Tính hiệu suất của phản ứng. -------------Hết------------ HƯỚNG DẪN CHẤM BÀI KIỂM TRA ĐÁNH GIÁ GIỮA KÌ I MÔN KHTN 8 – MÃ ĐỀ HS 01 Phần I. Trắc nghiệm khách quan: (5,0 điểm) Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 Câu 7 Câu 8 D B D D A C B B Câu 9 Câu 10 Câu 11 Câu 12 Câu 13 Câu 14 Câu 15 Câu 16 C D B B C A D B Câu 17 Câu 18 Câu 19 Câu 20 B C B A Phần II. Tự luận (5,0điểm) Câu Nội dung đáp án Biểu điểm Câu 21 a. Khái niệm khối lượng mol: Khối lượng mol ( kí hiệu là M ) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó b. Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan. 0,5 đ 0,5 đ Câu 22 Các yếu tố ảnh hưởng đến tốc độ phản ứng là + Nhiệt độ. + Nồng độ. + Diện tích bề mặt tiếp xúc. + Chất xúc tác. 1,0 đ Tính khối lượng của HCl đã phản ứng: Theo ĐLBTKL mzn + mHCl = mZnCl2 + mH2 mHCl = mZnCl2 + mH2 – mZn = 27,2 + 0,4 – 13 = 14,6 (g) 0,5 đ Câu 23 a. Tính thể tích khí H 2 ở 25 độ C và 1 bar PTHH: Fe + 2HCl -> FeCl2 + H2 nFe = m:M = 0,56: 56 = 0,1 (mol) Theo PTHH: nH2 = nFe = 0,1 mol => VH2 = n.24,79 = 0,1.24,79 = 2,479(l) 0,5 đ b. Tính thể tích dung dich hydrochloric acid đã dùng. Theo PTHH nHCl = 2nFe = 2.0,1 = 0,2 (mol) VHCl = n : CM = 0,2 : 2 = 0,1 (l) 0,5 đ Câu 24 - Đánh số thứ tự 2 lọ hoá chất. Nhỏ mỗi lọ 1 giọt dung dịch lên mảnh giấy quỳ tím. Nếu quỳ tím chuyển màu xanh suy ra dung dịch nhỏ là NaOH. Còn lại không có hiện tượng gì là NaCl 0,5 đ Câu 25 PTHH: 2CO + O2 → 2CO2 Trước phản ứng: 16 6 0 (lít) Phản ứng: 2x x 2x (lít) Sau phản ứng: 16-2x 6-x 2x (lít) Ta có hỗn hợp khí sau phản ứng là 18 lít, tức là: 16-2x + 6-x +2x =18 → x = 4 PTHH: 2CO + O2 → 2CO2 Thể tích (lít) 16 6 Lập tỉ lệ > → Nếu phản ứng xảy ra hoàn toàn, O2 sẽ hết và CO dư, nên tính hiệu suất theo thể tích khí O2 Hiệu suất của phản ứng là Vậy hiệu suất của phản ứng là 66,67%. 1đ Duyệt của Ban giám hiệu Duyệt của tổ chuyên môn Người ra đề Hà Văn Phương Trường PTDTBT&THCS ĐỀ KIỂM TRA GIỮA KÌ I PHÌN NGAN MÔN: KHOA HỌC TỰ NHIÊN LỚP 8 ( Thời gian: 90 phút không kể phát đề ) ĐỀ 2 Phần I. Trắc nghiệm khách quan: (5,0 điểm) Khoanh tròn vào chữ cái trước câu trả lời đúng: Câu 1: Vôn kế dùng để làm gì? A. Đo hiệu điện thế. B. Đo cường độ dòng điện. C. Đo chiều dòng điện. D. Kiểm tra có điện hay không. Câu 2: Biến đổi vật lí là gì? A. Chuyển trạng thái này sang trạng thái khác. B. Chuyển nồng độ này sang nồng độ khác. C. Chuyển từ thể tích này sang thể tích khác. D. Tất cả các đáp trên. Câu 3: Điền vào chỗ trống: “Khối lượng mol (g/mol) và khối lượng nguyên tử hoặc phân tử của chất đó (amu) bằng nhau về ..., khác về đơn vị đo”. A. Khối lượng. B. Trị số. C. Nguyên tử. D. Phân tử. Câu 4: Khi đun nóng hoá chất trong ống nghiệm cần kẹp ống nghiệm bằng kẹp ở khoảng bao nhiêu so với ống nghiệm tính từ miệng ống? A. 1/2. B. 1/4. C. 1/6. D. 1/3. Câu 5: Các thí nghiệm về điện ở môn KHTN thường dùng nguồn điện để có bộ nguồn 6V thì dùng pin nào? A. Một pin 3V. B. Hai pin 3V. C. Ba pin 2V. D. Bốn pin 1,5V. Câu 6: Chất được tạo thành sau phản ứng hóa học là? A. Chất phản ứng. B. Chất lỏng. C. Chất sản phẩm. D. Chất khí. Câu 7: Dùng nước mưa đun sôi rồi để nguội làm nước uống, lâu ngày thấy trong ấm có những cặn trắng. Biết rằng trong nước mưa có chứa nhiều muối calcium hydrogen carbonate (Ca(HCO 3)2). Muối này dễ bị nhiệt phân hủy sinh ra calcium carbonate (là chất kết tủa trắng), khí carbon dioxide và nước. Hãy cho biết dấu hiệu có phản ứng xảy ra khi đun nước sôi rồi để nguội. A. Do tạo thành nước. B. Do tạo thành chất kết tủa trắng calcium carbonate. C. Do để nguội nước. D. Do đun sôi nước Câu 8: Cho tỉ khối của khí A đối với khí B là 0,0625 và tỉ khối của khí B đối với không khí là 1,104. Khối lượng mol của khí A là: A. 2 B. 32 C. 29 D. 16 Câu 9: Tỉ khối hơi của khí sulfur dioxide (SO2) so với khí oxygen (O2) là A. 0,5 B. 1,5 C. 2,0 D. 4,0 Câu 10: Ở 25 oC và 1 bar, 0,5 mol khí chiếm thể tích bao nhiêu? A. 22,4 l. B.24,79 l. C. 1,12 l. D. 12,395 l Câu 11: Hãy cho biết 32g khí oxi ở 1 bar và 25oC có thể tích là: A. 4,958 lít. B. 24,79 lít. C. 24 lít. D. 2,479 lít. Câu 12: Phương trình đúng của phosphorus cháy trong không khí, biết sản phẩm tạo thành là P2O5 A. P + O2 → P2O5 B. 4P + 5O2 → 2P2O5 C. P + 2O2 → P2O5 D. P + O2 → P2O3 Câu 13: Sulfur cháy theo sơ đồ phản ứng sau: Sulfur + khí oxygen → sulfur dioxide. Nếu đốt cháy 32 gam sulfur thì khối lượng oxygen đã tham gia vào phản ứng là: A. 3,2 gam B. 16 gam C. 32 gam D. 1,6 gam Câu 14: Trộn 10,8 gam bột nhôm (aluminium) với bột lưu huỳnh (sulfur). Cho hỗn hợp vào ống nghiệm và đun nóng để phản ứng xảy ra thu được 25,5 gam Al2S3. Tính hiệu suất phản ứng? A. 85% B. 80% C. 90% D. 92% Câu 15: Acid là những chất làm cho quỳ tím chuyển sang màu nào trong số các màu sau đây? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 16: Nồng độ phần trăm của một dung dịch cho ta biết A. số mol chất tan trong một lít dung dịch. B. số gam chất tan có trong 100 gam dung dịch. C. số mol chất tan có trong 150 gam dung dịch. D. số gam chất tan có trong dung dịch. Câu 17: Sulfuric acid đặc nóng tác dụng với đồng kim loại sinh ra khí: A. CO2. B. SO2. C. SO3. D. H2S. Câu 18: Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí: A.BaO và H2SO4 C. Zn và H2SO4 Ba(OH)2 và H2SO4 D. Na2O và H2SO4 Câu 19: Điền vào chỗ trống: “Base là những ... trong phân tử có nguyên tử kim loại liên kết với nhóm .... Khi tan trong nước, base tạo ra ion ...” A. Đơn chất, hydrogen, OH− B. Hợp chất, hydroxide, OH− C. Đơn chất, hydroxide, H+ D. Hợp chất, hydrogen, H+ Câu 20: Base nào là kiềm? A. NaOH. B. Cu(OH)2. C. Mg(OH)2. D. Fe(OH)2. Phần II. Tự luận (5,0điểm) Câu 21. ( 1 điểm ) a. Nêu khái niệm tỉ khối của chất khí. b. Nêu định nghĩa độ tan của một chất trong nước. Câu 22. (1,5điểm) a. Hãy nêu các yếu tố làm thay đổi tốc độ phản ứng. b. Cho 6,5 gam zinc (Zn) tác dụng với dung dịch hydrochloric acid (HCl) thu được 13,6 gam ZnCl2 và 0,2 gam khí H2. Tính khối lượng của HCl đã phản ứng. Câu 23. (1,0điểm) Hòa tan hết 11,2 gam Fe trong dung dịch hydrochloric acid (HCl) 2M, sau phản ứng thu được FeCl2 và khí H2. a. Tính thể tích khí H 2 ở 25 độ C và 1 bar . b. Tinh thể tích dung dịch hydrochloric acid đã dùng. Câu 24. (0,5điểm) Có 2 lọ mất nhãn đựng 2 dung dịch KOH và KCl, hãy nêu cách nhận biết 2 dung dịch trên? Câu 25. (1,0điểm) Đốt 16 lít CO trong bình với 6 lít O2. Sau phản ứng thu được 18 lít hỗn hợp khí. Tính hiệu suất của phản ứng. -------------Hết------------ HƯỚNG DẪN CHẤM BÀI KIỂM TRA ĐÁNH GIÁ GIỮA KÌ I MÔN KHTN 8 – MÃ ĐỀ HS 02 Phần I. Trắc nghiệm khách quan: (5,0 điểm) Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 Câu 7 Câu 8 A A B D D C D A Câu 9 Câu 10 Câu 11 Câu 12 Câu 13 Câu 14 Câu 15 Câu 16 C D B B C A B B Câu 17 Câu 18 Câu 19 Câu 20 B C B A Phần II. Tự luận (5,0điểm) Câu Nội dung đáp án Biểu điểm Câu 21 a. Tỉ khối của khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B. b. Độ tan ( Kí hiệu là S ) của một chất trong nước là số gam chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở một nhiệt độ, áp suất nhất định. 0,5 đ 0,5 đ Câu 22 Các yếu tố ảnh hưởng đến tốc độ phản ứng là + Nhiệt độ. + Nồng độ. + Diện tích bề mặt tiếp xúc. + Chất xúc tác. 1,0 đ Tính khối lượng của HCl đã phản ứng: Theo ĐLBTKL mzn + mHCl = mZnCl2 + mH2 mHCl = mZnCl2 + mH2 – mZn = 13,6 + 0,2 – 6,5 = 7,3 (g) 0,5 đ Câu 23 a. Tính thể tích khí H 2 ở 25 độ C và 1 bar PTHH: Fe + 2HCl -> FeCl2 + H2 nFe = m:M = 11,2: 56 = 0,2 (mol) Theo PTHH: nH2 = nFe = 0,2 mol => VH2 = n.24,79 = 0,2.24,79 = 4,958(l) 0,5 đ b. Tính thể tích dung dich hydrochloric acid đã dùng. Theo PTHH nHCl = 2nFe = 2.0,2 = 0,4 (mol) VHCl = n : CM = 0,4 : 2 = 0,2 (l) 0,5 đ Câu 24 - Đánh số thứ tự 2 lọ hoá chất. Nhỏ mỗi lọ 1 giọt dung dịch lên mảnh giấy quỳ tím. Nếu quỳ tím chuyển màu xanh suy ra dung dịch nhỏ là KOH. Còn lại không có hiện tượng gì là KCl 0,5 đ Câu 25 PTHH: 2CO + O2 → 2CO2 Trước phản ứng: 16 6 0 (lít) Phản ứng: 2x x 2x (lít) Sau phản ứng: 16-2x 6-x 2x (lít) Ta có hỗn hợp khí sau phản ứng là 18 lít, tức là: 16-2x + 6-x +2x =18 → x = 4 PTHH: 2CO + O2 → 2CO2 Thể tích (lít) 16 6 Lập tỉ lệ > → Nếu phản ứng xảy ra hoàn toàn, O2 sẽ hết và CO dư, nên tính hiệu suất theo thể tích khí O2 Hiệu suất của phản ứng là Vậy hiệu suất của phản ứng là 66,67%. 1,0đ Duyệt của Ban giám hiệu Lương sỹ Dương Duyệt của tổ chuyên môn Nguyễn Thị Thảo Người ra đề Hà Văn Phương
Tài liệu đính kèm:
 de_kiem_tra_giua_ki_i_mon_khoa_hoc_tu_nhien_lop_8_chan_troi.docx
de_kiem_tra_giua_ki_i_mon_khoa_hoc_tu_nhien_lop_8_chan_troi.docx






