Kiểm tra học kì I – Lớp 9 năm học: 2015 – 2016 môn: Hóa học thời gian làm bài: 45 phút (không kể thời gian phát đề)
Bạn đang xem tài liệu "Kiểm tra học kì I – Lớp 9 năm học: 2015 – 2016 môn: Hóa học thời gian làm bài: 45 phút (không kể thời gian phát đề)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
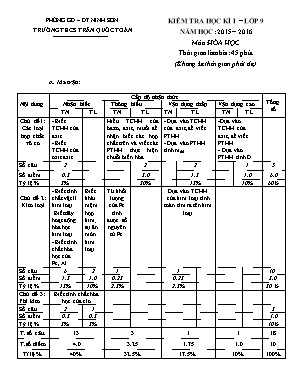
PHÒNG GD – ĐT NINH SƠN TRƯỜNG THCS TRẦN QUỐC TOẢN KIỂM TRA HỌC KÌ I – LỚP 9 NĂM HỌC: 2015 – 2016 Môn: HÓA HỌC Thời gian làm bài: 45 phút (Không kể thời gian phát đề) A. Ma trận: Nội dung Cấp độ nhận thức Tổng số Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao TN TL TN TL TN TL TN TL Chủ đề1: Các loại hợp chất vô cơ - Biết TCHH của axit. - Biết TCHH của oxit axit Hiểu TCHH của bazơ, axit, muối để nhận biết các hợp chất trên và viết các PTHH thực hiện chuỗi biến hóa - Dựa vào TCHH của axit, để viết PTHH. - Dựa vào PTHH tính mdd -Dựa vào TCHH của axit, để viết PTHH. - Dựa vào PTHH tính D Số câu 2 2 2 1 5 Số điểm 0.5 3.0 1.5 1.0 6.0 Tỷ lệ % 5% 30% 15% 10% 60% Chủ đề 2: Kim loại - Biết tính chất vật lí kim loại .Biết dãy hoạt động hóa học kim loại - Biết tính chất hóa học của Fe, Al Biết khái niệm hợp kim; sự ăn mòn kim loại Từ khối lượng của Fe tính được số nguyên tử Fe. Dựa vào TCHH của kim loại tính toán tìm ra tên kim loại. Số câu 6 2 1 1 10 Số điểm 1.5 1.0 0.25 0.25 3.0 Tỷ lệ % 15% 10% 2.5% 2.5% 30 % Chủ đề 3: Phi kim Biết tính chất hóa học của clo Số câu 2 1 3 Số điểm 0.5 0.5 1.0 Tỷ lệ % 5% 5% 10% T. số câu. 13 3 1 1 18 T.số điểm 4.0 3.25 1.75 1.0 10 Tỉ lệ % 40% 32.5% 17.5% 10% 100% PHÒNG GD – ĐT NINH SƠN TRƯỜNG THCS TRẦN QUỐC TOẢN ĐỀ KIỂM TRA HỌC KÌ I – LỚP 9 NĂM HỌC: 2015 – 2016 Môn: HÓA HỌC Thời gian làm bài: 45 phút (Không kể thời gian phát đề) ĐỀ : (Đề gồm 2 trang) I. Trắc nghiệm khách quan: (3 điểm) Câu 1: Kết luận nào sau đây đúng khi nói về axit: A. Dung dịch axit làm đổi màu quì tím thành xanh B. Dung dịch axit tác dụng được với mọi kim loại và giải phóng khí H2 C. Axit tác dụng được với bazơ tạo thành muối và nước D. Axit chỉ tác dụng được với các oxit bazơ tan được trong nước. Câu 2: Khí oxi bị lẫn tạp chất là các khí CO2, SO2, H2S. Có thể dùng chất nào sau đây để loại bỏ tạp chất? A. Nước B. Dung dịch Ca(OH)2 C. H2SO4loãng D. CuSO4 Câu 3: Khi đun nóng hỗn hợp Fe và S thì tạo thành sản phẩm nào sau đây: A. Fe2S3 B. FeS C. FeS2 D. Fe2S3 và FeS. Câu 4: Số nguyên tử sắt có trong 280 g sắt là: A. 10,1 x 1023 B. 20,1 x 1023 C. 25,2 x 1023 D. 30,1 x 1023 Câu 5: Kim loại nào sau đây có tính dẫn điện tốt nhất trong số tất cả các kim loại? A. Vàng B. Bạc C. Đồng D. Nhôm Câu 6: Cho kim loại X tác dụng với dung dịch H2SO4loãng để lấy khí H2 khử oxit kim loại Y (các phản ứng đều xảy ra). X và Y có thể là những kim loại nào? A. Đồng và sắt B. Sắt và đồng C. Đồng và bạc D. Bạc và đồng Câu 7: Dãy các kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần? A. K, Mg, Cu, Al, Zn, Fe B. Fe,Cu, K, Mg, Al, Zn C. Cu, Fe, Zn, Al, Mg, K D. Zn, K, Mg Cu, Al, Fe Câu 8: Sau một ngày lao động người ta phải làm vệ sinh các thiết bị, máy móc, dụng cụ lao động bằng kim loại. Việc làm này có mục đích chính là gì? A. Để kim loại sáng bóng đẹp mắt B. Để không gây ô nhiễm môi trường C. Để kim loại đỡ bị ăn mòn D. Để không làm bẩn quần áo khi lao động Câu 9: Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2. Có thể dùng chất nào sau đây để làm sạch muối nhôm? A. AgNO3 B. HCl C. Mg D. Al Câu 10: Cho 1.4 g kim loại hóa trị II tác dụng hết với dung dịch HCl thu được 0.56 lit khí H2 (đktc). Hỏi đó là kim loại nào trong số các kim loại sau: A. Mg B. Zn C. Ni D. Fe Câu 11: Trong bốn hỗn hợp dưới đây, hỗn hợp nào là nước Gia-ven? NaCl + NaClO + H2O B. NaCl + NaClO2 + H2O C. NaCl + NaClO3 + H2O D. NaCl + NaClO4 + H2O Câu 12: Chọn phát biểu đúng về hiđro clorua ở điều kiện thường: A. Là chất khí tan nhiều trong nước B. Là chất khí không tan trong nước C. Là chất lỏng tan nhiều trong nước D. Là chất lỏng không tan trong nước II. Tự luận: (7 điểm) Câu 13: Hợp kim là gì? (0.5đ) Câu 14: Thế nào là sự ăn mòn kim loại? (0.5đ) Câu 15: Có thể thu khí clo bằng cách đẩy nước được không? Vì sao? (0.5đ) Câu 16: (1.5đ) Viết các phương trình hóa học biểu diễn chuyển đổi hóa học sau: Fe FeCl2 Fe(OH)2 FeO Câu 17: (1.5đ) Có 4 lọ không nhãn mỗi lọ đựng một dung dịch các chất sau: Ba(OH)2, AgNO3, NaCl, HCl. Hãy nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết phương trình hóa học. Câu 18: (2.5đ). Trung hòa 200 ml dung dịch axit nitric 2M bằng dung dịch bari hiđroxit 10%. a) Viết phương trình phản ứng xảy ra, b) Tính khối lượng dung dịch Ba(OH)2 đã dùng. c) Thay dung dịch bari hiđroxit bằng 400 ml dung dịch canxi hiđroxit 5%. Hãy tính khối lượng riêng của dung dịch canxi hiđroxit để trung hòa lượng axit trên. (Cho Ba = 137; O = 16; H = 1; Ca = 40; Fe = 56) -------HẾT------- Giáo viên ra đề Trần Thị Dư PHÒNG GD – ĐT NINH SƠN TRƯỜNG THCS TRẦN QUỐC TOẢN KIỂM TRA HỌC KÌ I – LỚP 9 NĂM HỌC: 2015 – 2016 Môn: HÓA HỌC Thời gian làm bài: 45 phút ĐÁP ÁN – BIỂU ĐIỂM. I. Trắc nghiệm: (3đ) Câu 1 2 3 4 5 6 7 8 9 10 11 12 Đáp án C B B D B B C C D D A A Biểu điểm 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 II. Tự luận: (7đ) CÂU ĐÁP ÁN Biểu điểm Câu 13: Hợp kim là chất rắn thu được sau khi làm nguội hỗn hợp nóng chảy của nhiều kim loại khác nhau hoặc của kim loại và phi kim 0.5đ Câu 14: Sự phá hủy kim loại và hợp kim do tác dụng hóa học trong môi trường 0.5đ Câu 15: Không thể thu khí clo bằng cách đẩy nước được. Vì clo tan trong nước. 0.5đ Câu 16: Fe + 2HCl FeCl2 + H2 0.5đ FeCl2 + 2NaOH Fe(OH)2 + 2NaCl 0.5đ Fe(OH)2 FeO + H2O 0.5đ Câu 17: Trích mỗi lọ một ít cho vào ống nghiệm để làm mẫu thử. Nhúng quì tím vào 4 ống nghiệm. Ống nghiệm có quì tím chuyển sang đỏ là HCl, Ống nghiệm có quì tím chuyển sang xanh là Ba(OH)2. Hai ống nghiệm còn lại có quì tím không đổi màu là AgNO3 và NaCl. 0.5đ - Cho dd NaCl vào 2 ống nghiệm còn lại. Ống nghiệm có kết tủa trắng là AgNO3, ống nghiệm không có hiện tượng gì là NaCl 0.5đ PTHH: AgNO3 + NaCl AgCl + NaNO3 0.5đ Câu 18: a) 2HNO3 + Ba(OH)2 Ba(NO3)2 + 2H2O 0.5đ b) nHNO3 = 0,2 x 2 = 0,4 (mol) 0.25đ 2HNO3 + Ba(OH)2 Ba(NO3)2 + 2H2O (mol) 2 : 1 : (mol) 0,4 0,2 0.25đ mBa(OH)2 = 0,2 x 171 = 34,2 (g) 0.25đ mddBa(OH)2 = (34,2 x 100) : 10 = 342 (g) 0.25đ c) 2HNO3 + Ca(OH)2 Ca(NO3)2 + 2H2O (mol) 2 : 1 (mol) 0,4 0,2 0.25đ mCa(OH)2 = 0,2 x 74 = 14,8 (g) 0.25đ mddCa(OH)2 = (14,8 x 100) : 5 = 296 (g) 0.25đ DddCa(OH)2 = 296 : 400 = 0,74 (g/ml). 0.25đ
Tài liệu đính kèm:
 DE KT HKI HOA 9 DU.doc
DE KT HKI HOA 9 DU.doc





