Đề kiểm tra tiết 62 – tuần 31 môn: Hóa học 9
Bạn đang xem tài liệu "Đề kiểm tra tiết 62 – tuần 31 môn: Hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
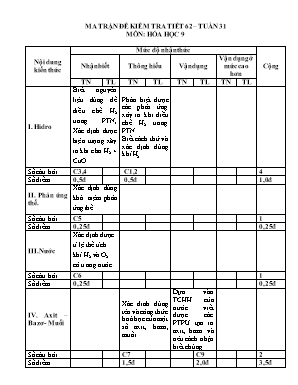
MA TRẬN ĐỀ KIỂM TRA TIẾT 62 – TUẦN 31 MÔN: HÓA HỌC 9 Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL I. Hidro Biết nguyên liệu dùng để điều chế H2 trong PTN, Xác định được hiện tượng xãy ra khi cho H2 + CuO Phân biệt được các phản ứng xảy ra khi điều chế H2 trong PTN. Biết cách thử và xác định đúng khí H2 Số câu hỏi C3,4 C1,2 4 Số điểm 0,5đ 0,5đ 1,0đ II. Phản ứng thế. Xác định đúng khái niệm phản ứng thế Số câu hỏi C5 1 Số điểm 0,25đ 0,25đ III. Nước Xác định được tỉ lệ thể tích khí H2 và O2 có trong nước Số câu hỏi C6 1 Số điểm 0,25đ 0,25đ IV. Axit – Bazơ - Muối Xác đinh đúng tên và công thức hoá học của một số axit, bazơ, muối. Dựa vào TCHH của nước viết được các PTPƯ tạo ra axit, bazơ và nêu cách nhận biết chúng. Số câu hỏi C7 C9 2 Số điểm 1,5đ 2,0đ 3,5đ V. Bài tập tổng hợp Hoàn thành các PTPƯ dựa vào TCHH của H2 và H2O. Củng cố kỹ năng tính toán số mol, thể tích theo PTHH Số câu hỏi C8 C10 2 Số điểm 2,0đ 3,0đ 5,0đ Tổng số câu 4 3 1 2 10 Tổng số điểm 1,0đ 2,0đ 2,0đ 5,0đ 10,0đ Trường THCS TÂN DUYỆT Họ tên: Lớp: .. Kiểm tra 1 tiết Môn: Hoá học 8 Thời gian: 45’ Điểm Lời phê của giáo viên PhÇn I: Tr¾c nghiÖm (3đ): Khoanh tròn đáp án đúng nhất trong các câu sau: Câu 1 : Phản ứng hóa học nào dưới đây dùng để điều chế khí Hiđro (H2) trong phòng thí nghiệm : A . Zn + 2HCl à ZnCl2 + H2 C. H2O + C CO + H2 B . 2H2O 2H2 + O2 D. CH4 C + 2H2 Câu 2 : Đốt khí Hidro trong không khí sẽ có : A. Khói trắng B. Ngọn lửa màu xanh nhạt C. Ngọn lửa màu đỏ D. Khói đen và hơi nước tạo thành . Câu 3: Nguyên liệu điều chế H2 trong phòng thí nghiệm là: A. Al, Zn B. HCl, Zn C. HCl, H2O D.MgO, HCl C©u 4: Khi cho luồng khí hidro đi qua bột đồng (II) oxit (ở nhiệt độ cao) thì sẽ có hiện tượng: A. màu đen B. màu vàng C. màu đen sang đỏ D. màu đỏ sang màu đen Câu 5 : Phản ứng thế là phản ứng hóa học : A . giữa đơn chất với hợp chất . B. trong đó một chất sinh ra nhiều chất mới C. giữa đơn chất với đơn chất . D . giữa đơn chất với hợp chất trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố trong hợp chất . C©u 6: Nước được tổng hợp theo tỉ lệ thể tích là: A. 2 thể tích O2 và 1 thể tích H2 B. 1 thể tích O2 và 2 thể tích H2 C. Bằng nhau D. 2 phần H2 và 1 phần O2 Ghép cột A với cột B vào phần trả lời của bảng dưới đây: Câu 7; Hãy chọn các công thức ở cột A và tên gọi ở cột B vào phần trả lời CỘT A CỘT B TRẢ LỜI A. HCl B. Al(OH)3 C. KNO3 D. NaH2PO4 E. Fe(OH)3 F. H2SO4 1. Sắt(III)hiđroxit; 2. Axitsunfuric 3. Kalinitrat; 4. Axitclohiđric 5. Natriđihiđrophotphat; 6. Natrihiđrophotphat 7. Axitsunfurơ; 8. Nhôm hiđroxit A+ B + C+ D+ E+ F+ Phần II.Tự luận(7đ): Câu 8.Hoàn thành các phương trình phản ứng sau: (2đ) a. H2 + O2 ----> ? b. Fe2O3 + H2 ----> Fe + H2O c. Fe + ? ----> FeSO4 + ? d. CuO + ? ----> ? + H2O Câu 9: (2đ) Cho các chất sau đây: CaO; H2O; P2O5. Hãy viết phương trình phản ứng hoá học tạo ra axit photphoric ( H2SO4) và Natrihiđroxit(NaOH). Nêu cách nhận biết 2 dung dịch trên. Bµi 3: (3đ) a.Viết phương trình phản ứng điều chế hiđrô từ kẽm và dung dịch H2SO4 loãng. b.Tính thể tích H2 thu được (ở điều kiện tiêu chuẩn) khi cho 13gam kẽm tác dụng với dung dịch axit H2SO4 loãng. ( Biết Zn = 65; O = 16; S = 32; H = 1) ®¸p ¸n - thang ®iÓm PhÇn I: (3®iÓm) 1. A 2.B 3.B 4.C 5.D 6.B 7. A + 4; B + 8; C + 3; D + 5; E + 1; F + 2. PhÇn II. Tù luËn (7 ®iÓm) Lêi gi¶i §iÓm Câu 8 (2 ®iÓm). Ph¬ng tr×nh ph¶n øng a. 2H2 + O2 2 H2O 0,5 ®iÓm b. Fe2O3 + 3H2 2Fe + 3H2O 0,5 ®iÓm c. Fe + H2SO4 à FeSO4 + H2 0,5 ®iÓm d. CuO + H2 Cu + H2O 0,5 ®iÓm Câu 9: CaO + H2O Ca(OH)2 P2O5 + 3H2O 2H3PO4 Dùng giấy quỳ tím cho vào 2 lọ, lọ nào làm giấy quỳ tím chuyển sang màu xanh đó là lọ chứa dung dịch bazơ, lọ nào làm giấy quỳ tím chuyển sang màu đỏ đó là lọ chứa dung dịch axit. 0,5đ 0,5đ 1,0đ Bµi 3 (3,0). a. Ph¬ng tr×nh ho¸ häc Zn + H2SO4 à ZnSO4 + H2 0,5 ®iÓm 13 b. nZn = = 0,2 mol 65 1,0 ®iÓm Theo ph¬ng tr×nh: nH2 = nZn = 0,2 mol 0,5 ®iÓm => VH2 ë ®ktc lµ: 0,2 . 22,4 = 4,48 lÝt 1,0 ®iÓm
Tài liệu đính kèm:
 de_KT_hoa_8_tuan_31.doc
de_KT_hoa_8_tuan_31.doc





